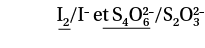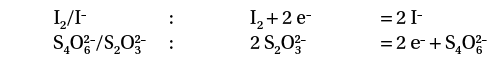Légende de la leçon
Vert : définitions
I. L’oxydant et le réducteur
1) Le nombre d’oxydation dans une espèce inorganique
Un nombre d’oxydation est le nombre de charges électriques élémentaires réelles ou fictives que porte un atome au sein d’une espèce chimique. On le note en chiffre romain.
Sa valeur :
- est nulle dans le cas d’un atome ou d’une molécule ne contenant qu’une sorte d’atome. Exemple : 0 pour l’élément aluminium dans Al, pour l’élément hydrogène dans H2 ;
- est égale à la charge dans le cas d’un ion monoatomique. Exemple : – I pour l’élément chlore dans l’ion chlorure Cl–, + III pour l’élément aluminium dans l’ion aluminium Al3+ ;
- se calcule en considérant que l’élément :
- possède tous les électrons des liaisons chimiques établies avec les atomes moins électronégatifs que lui, ce qui se traduit donc pour lui par un gain d’électron(s) ;
- ne possède aucun des électrons des liaisons chimiques établies avec les atomes plus électronégatifs que lui, ce qui se traduit par une perte d’électron(s).
Exemples
• Dans CO2, O = C = O, l’élément oxygène est plus électronégatif que l’élément carbone, on considère que l’oxygène a pris les deux électrons des liaisons chimiques : son nombre d’oxydation est donc – II, ce qui est le cas en général. La molécule étant neutre, la somme des nombres d’oxydation est nulle, ainsi n.o.(C) + 2 n.o.(O) = 0. Le nombre d’oxydation du carbone vaut donc IV car n.o.(C) = -2 n.o.(O) = + IV.
• Dans MnO4–, l’élément oxygène, plus électronégatif que l’élément manganèse, a un nombre d’oxydation égal à – II. Il s’agit d’un ion, aussi la somme des nombres d’oxydation est égale à la charge de l’ion -I. Ainsi, n.o.(Mn) + 4 n.o.(O) = -I. Le nombre d’oxydation du manganèse vaut donc VII car n.o.(Mn) = - I - 4 n.o.(O) = + VII.
• Dans Cr2O72–, l’élément oxygène, plus électronégatif que l’élément chrome, a un nombre d’oxydation égal à -II. Il s’agit d’un ion, aussi la somme des nombres d’oxydation est égale à la charge de l’ion – II. Ainsi 2 n.o.(Cr) + 7 n.o.(O) = – II. Le nombre d’oxydation du chrome vaut donc VI car n.o.(Cr) = ½ (- II – 7 n.o.(O)) = + VI.
Dans une réaction chimique d’oxydoréduction, on peut déterminer l’oxydant et le réducteur en prenant en compte les nombres d’oxydation. L’oxydant est l’espèce pour laquelle le nombre d’oxydation de l’élément chimique a la plus grande valeur et le réducteur, l’espèce pour laquelle le nombre d’oxydation a la plus petite valeur.
Exemple
Dans la réaction 2 I– + H2O2 + 2 H+ → I2 + 2 H2O, les valeurs des nombres d’oxydation sont :
- pour l’élément iode : -I dans I– et 0 dans I2, donc l’oxydant est le diiode I2 et le réducteur est l’ion iodure I– ;
- pour l’élément oxygène : –I dans H2O2 (car la molécule s’écrit H–O–O–H : chaque atome d’oxygène ne peut prendre que l’électron de la liaison O-H mais pas celui de la liaison O–O) et –II dans H2O, donc l’oxydant est l’eau oxygénée H2O2 et le réducteur est l’eau H2O.
Il se produit une réaction entre l’oxydant – l’eau oxygénée H2O2 – et le réducteur – l’ion iodure I–.
2) Définitions
Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons en solution aqueuse. Quand l’oxydant a capté un ou plusieurs électrons, il est réduit.
Exemple
L’ion Fe2+ est un oxydant, il se transforme en fer métallique en captant 2 électrons :
Fe2+ + 2 e– = Fe.
Quelques oxydants usuels : le dioxygène gazeux O2, le dichlore gazeux Cl2, le diiode I2 en solution, l’eau oxygénée H2O2 en solution.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons en solution aqueuse. Quand le réducteur a cédé un ou plusieurs électrons, il est oxydé.
Exemple
Le lithium métallique est réducteur, il se transforme en ion lithium en cédant un électron :
Li = Li+ + e –.
Quelques réducteurs usuels : le dihydrogène gazeux H2, l’ion fer (II) en solution.
3) Les couples oxydant/réducteur et la demi-réaction électronique
Un couple oxydant/réducteur comporte un oxydant Ox et un réducteur Réd. Une demi-équation électronique ou d’oxydoréduction lie les deux espèces chimiques :
Oxydant + n e– = Réducteur ou Ox + n e– = Réd
Ox et Réd forment le couple oxydant/réducteur Ox/Réd.
Attention
La forme oxydante est toujours écrite en premier dans un couple oxydant réducteur ! On utilise un signe égal dans les demi-équations électroniques.
Exemple
En milieu acide : couple Cr2O72–(aq)/Cr3+(aq).
La demi-équation électronique est : Cr2O72–(aq) + n e– = Cr3+(aq).
Il faut assurer la conservation de l’élément chrome. Or, à gauche, l’ion dichromate Cr2O72– contient 2 éléments chrome. Il en faut aussi 2 à droite, ce qui est obtenu en plaçant un coefficient 2 devant Cr3+ : Cr2O72–(aq) + n e– = 2 Cr3+(aq).
Il faut assurer la conservation de l’élément oxygène. Or, à gauche, l’ion dichromate contient 7 éléments oxygène, il en faut donc 7 à droite sous forme d’eau :
Cr2O72–(aq) + n e– = 2 Cr3+(aq) + 7 H2O(l). Ceci ajoute 14 hydrogènes à droite, qui doivent figurer à gauche sous forme de H+ : Cr2O72–(aq) + n e– + 14 H+(aq) = 2 Cr3+(aq) + 7 H2O(l).
Il reste à équilibrer la charge : Cr2O72–(aq) + 6 e– + 14 H+(aq) = 2 Cr3+(aq) + 7 H2O(l).
4) La réaction d’oxydoréduction
Une réaction d’oxydoréduction se produit entre l’oxydant Ox1 d’un couple Ox1/Red1 et le réducteur Réd2 d’un autre couple Ox2/Réd2. Il y a transfert d’électrons :
- le réducteur 2 cède des électrons et est oxydé en oxydant 2 ;
- l’oxydant 1 capte les électrons cédés et est réduit en réducteur 1.
Le nombre d’électrons cédés par le réducteur 2 est égal au nombre d’électrons captés par l’oxydant 1, car les électrons ne peuvent pas exister à l’état libre en solution aqueuse.
Exemple
La réaction entre le diiode I2 et les ions thiosulfate S2O32–.
Il faut identifier les couples oxydant/réducteur mis en jeu et souligner les réactifs :
On écrit alors les demi-équations avec les réactifs à gauche :
On ajoute les deux demi-équations pour former l’équation. Comme chaque demi-équation nécessite deux électrons, ces électrons vont disparaître en faisant la somme :
L’équation est donc : I2 + 2 S2O32 → 2 I– + S4O62–
Cette équation signifie qu’il faut deux moles d’ions thiosulfate pour réagir avec une mole de diiode. On utilise une simple flèche si la réaction est totale.
II. Les piles
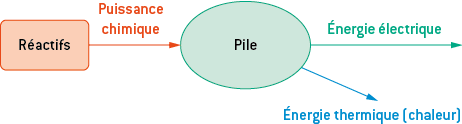
Initialement, le nom de « pile » désignait un empilement de rondelles de deux métaux différents en contact grâce à une solution ionique conduisant le courant, appelée électrolyte. Aujourd’hui, on appelle « pile » un générateur électrochimique monobloc constitué d’un seul élément, non rechargeable.
Une pile est un convertisseur d’énergie comme le montre le schéma ci-dessous.
1) Le fonctionnement d’une pile
a) Le transfert direct d’électrons
Si on plonge une lame métallique de zinc dans un bécher contenant une solution d’ions cuivre Cu2+(aq), la lame se couvre progressivement de cuivre métallique et la solution se décolore. Deux couples oxydant/réducteur interviennent : Cu2+(aq)/Cu(s) et Zn2+(aq)/Zn(s).
Une réaction d’oxydoréduction se produit entre le zinc et les ions cuivre selon :
Zn(s)+ Cu2+(aq) → Zn2+(aq)+ Cu(s).
Un transfert d’électrons se produit directement entre le zinc et les ions cuivre.
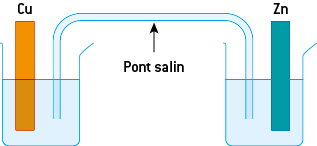
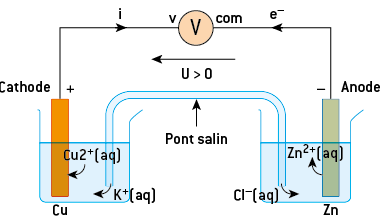
b) La constitution d’une pile au laboratoire
Il est possible de réaliser un transfert d’électrons, de manière indirecte, en réalisant une pile.
La pile permettant de reproduire la réaction précédente comporte :
- deux compartiments, appelés demi-piles, contenant une solution ionique d’un ion métallique dans laquelle trempe une électrode métallique du même métal ;
- un pont salin permettant la circulation des ions entre les deux demi-piles. Ce pont salin est constitué d’une solution ionique gélifiée placée dans un tube en U ou d’un simple papier imbibé d’une solution ionique. Les ions présents dans le pont salin assurent la continuité électrique entre les deux solutions : des électrons ne pourraient pas passer directement. Cette pile met en jeu les deux couples Cu2+(aq)/Cu(s)et Zn2+(aq)/Zn(s).
2) L’utilisation d’un appareil de mesure
Pour que le courant circule, la pile est connectée à un circuit électrique. Les électrons doivent alors circuler dans les fils électriques du circuit.
a) La mesure de la tension électrique
La tension aux bornes de la pile est mesurée à l’aide d’un voltmètre numérique placé en dérivation en mode continu. La tension électrique UAB est mesurée en reliant la borne « V » du voltmètre en A et la borne « com » en B. On obtient alors directement la polarité de la pile étudiée.
Si la tension mesurée est positive, alors la borne « V » du voltmètre est connectée à la borne positive de la pile, la cathode, et la borne « com » est connectée à la borne négative de la pile, l’anode : la tension entre la borne positive et la borne négative de la pile est positive.
Inversement, si la tension mesurée est négative, alors la borne « V » du voltmètre est connectée à la borne négative de la pile et la borne « com » est connectée à la borne positive de la pile : la tension entre la borne négative et la borne positive de la pile est négative.
b) La mesure de l’intensité électrique
On utilise le sens conventionnel du courant pour orienter un circuit : le courant parcourt le circuit, à l’extérieur du générateur, de la borne positive à la borne négative.
L’intensité du courant s’exprime en ampère de symbole A.
L’intensité du courant électrique se mesure à l’aide d’un ampèremètre numérique, branché en série en mode continu dans la branche étudiée. L’intensité du courant a la même valeur en tout point d’un circuit en série ou d’une branche.
L’indication lue est positive si le courant électrique arrive sur la borne « A » de l’ampèremètre.
Si la valeur lue est négative, c’est que le courant traverse l’ampèremètre de la borne « com » à la borne « A ». L’utilisation d’un ampèremètre permet donc de déterminer facilement quelle est la borne positive de la pile.
Attention
Il faut toujours prendre le calibre le plus élevé de l’ampèremètre ou du voltmètre avant de réaliser les mesures
c) La polarité d’une pile : mise en évidence des réactifs
Si l’on connecte l’électrode de cuivre à la borne volt du voltmètre et l’électrode de zinc à la borne « com », on mesure une tension positive.
L’oxydation se fait sur l’électrode d’où sont issus les électrons, l’anode, donc la borne négative. La réduction se produit sur l’autre électrode, la cathode, qui reçoit les électrons, donc la borne positive.
Cette pile comporte deux demi-piles contenant les couples Cu2+(aq)/Cu(s)et Zn2+(aq)/Zn(s).
L’oxydation a lieu sur l’électrode négative. Il y a oxydation du réducteur du couple, donc oxydation du zinc selon l’équation : Zn = Zn2+ + 2 e–.
La réduction a lieu sur l’électrode positive de cuivre, il y a donc réduction des ions Cu2+, ce qui conduit à un dépôt de cuivre métallique sur cette électrode selon l’équation : Cu2+(aq) + 2 e− = Cu(s).
La réaction globale se produisant dans la pile est donc :
Zn(s)+ Cu2+(aq) → Zn2+(aq) + Cu(s)
C’est la même réaction que celle qui s’effectue spontanément entre une lame métallique de zinc et des ions cuivre en solution. La pile permet d’utiliser une partie de l’énergie chimique transformée en énergie électrique.
La transformation chimique correspond à la réaction entre l’oxydant d’un couple et le réducteur d’un autre couple. La réaction ne se fait pas directement entre les deux espèces (c’est pour cela que le transfert est indirect), sinon on ne pourrait pas extraire d’énergie électrique de cette réaction.
Dans le pont salin, les cations se déplacent dans le même sens que celui du courant alors que les anions se déplacent dans le même sens que les électrons.
3) La quantité d’électricité disponible
Une pile transfère de l’énergie électrique au circuit. Il faut pouvoir établir un lien entre les quantités de réactifs mises en jeu et la quantité d’électricité qui va circuler.
La constante de Faraday (F) est la charge portée par une mole de charge élémentaire :
1 F = 9,65 × 104 C.mol−1.
La charge électrique Q est liée à la quantité d’électrons ayant circulé dans le circuit électrique.
Pour pouvoir établir un lien entre les quantités de charge débitées par la pile et les quantités de réactifs consommés, il faut prendre en compte les demi-réactions.
Pour la pile précédente, on a Cu2+(aq) + 2e− = Cu(s). Il faut deux fois plus d’électrons que d’ions cuivre, donc ne- = 2 nCu2+.
Exemple
On dispose d’une pile pour laquelle l’ion cuivre (II) serait le réactif limitant avec une quantité initiale nCu2+ = 0,020 mol. Cette pile peut donc mettre en jeu une quantité d’électrons ne- = 2 nCu2+ = 0,040 mol. La capacité théorique Q = ne- × F = 0,040 × 96 500 = 3,9 × 103 C.