Légende de la leçon
Vert : définitions
I. La constante d’équilibre Ka
1) Rappels
Les propriétés acides ou basiques d’une solution vont dépendre de la concentration en ion oxonium H3O+, notée [H3O+].
Le pH est donc une grandeur liée à la concentration en ion oxonium :
pH = –log [H3O+], où [H3O+] est exprimée en mol.L–1.
Inversement, la concentration en ions oxonium [H3O+] est liée au pH par : [H3O+] = 10–pH.
Plus une solution contient des ions H3O+, plus son pH est faible.
2) La constante d’acidité Ka et pKa
On appelle constante d’acidité dans l’eau du couple HA/A–, notée Ka, la grandeur sans dimension associée à l’équation HA + H2O ⇄ A– + H3O+ : Ka=A−×H3O+HA.
Le pKa d’un couple acide-base est défini par pKa=− log Ka.
Le pKa d’un couple HA/A– est lié au pH de la solution par la relation pH=pKa+logA−HA.

Les acides et bases faibles ont une valeur de pKa du couple associé comprise entre 0 et 14.
3) Le coefficient de dissociation α d’un acide faible
Le coefficient de dissociation α correspond au pourcentage de transformation de l’acide faible en sa base faible conjuguée lors de la réaction avec l’eau : AH + H2O ⇄ A– + H3O+.
Si on note Co = [AH]0 la concentration molaire en acide apporté, alors, en utilisant le coefficient de dissociation α : [AH] = (1 – α) × Co = (1 – α) × [AH]0 et [A–] = α × Co = α × [AH]0.
En effet, la conservation de la matière indique que l’acide AH s’est soit transformé en base conjuguée A–, soit est resté sous sa forme AH. Par conséquent, la concentration initiale en acide AH, [AH]0, est bien la somme des concentrations réelles de l’acide AH et de la base A– : [AH]0 = [AH] + [A–] = (1 – α) × [AH]0 + α × [AH]0.
Remarque
D’après l’équation de la réaction, [H3O+] = [A–], on a :
[H3O+] = [A–] = α × Co = α × [AH]0.
Il est donc possible de calculer le taux de dissociation α à partir de la concentration initiale [AH]0 et de la valeur du pH, puisque [H3O+] = 10–pH.
La constante d’acidité s’écrit alors :
Ka = [A–] × [H3O+]/[AH] = (α × [AH]0) × (α × [AH]0)/(1 – α) × [AH]0) = (α2/(1 – α)) × [AH]0.
Exemple
La valeur du pH d’une solution d’acide éthanoïque de concentration [CH3COOH]0 = C0 = 0,10 mol.L–1 est égale à 2,9.
La réaction responsable de cette acidité est CH3COOH + H2O ⇄ CH3COO– + H3O+.
La concentration en ion oxonium vaut [H3O+] = 10–2,9 = 1,3 × 10–3 mol.L–1.
Or, [CH3COO–] = [H3O+] = 10–2,9 = 1,3 × 10–3 mol.L–1 et [CH3COO–] = α × [CH3COOH]0, ainsi α = [CH3COO–]/[CH3COOH]0 = 1,3 × 10–3/0,10 = 1,3 × 10–2 = 1,3 %.
L’acide éthanoïque réagit peu avec l’eau.
4) L’évolution du coefficient de dissociation avec la dilution
La constante d’acidité Ka peut s’exprimer en fonction du coefficient de dissociation et de la concentration initiale : Ka = (α2/(1 – α)) × [AH]0.
Or, Ka est constante pour une température donnée. Lors de la dilution de l’acide, la concentration [AH]0 diminue. Le rapport α2/(1 – α) doit augmenter, ce qui se produit si α augmente aussi.
Ainsi, lorsque l’on dilue un acide dans l’eau, il réagit davantage avec l’eau et il en reste moins en proportion.
Exemple
La valeur du pH d’une solution d’acide éthanoïque de concentration [CH3COOH]0 = C0 = 0,010 mol.L–1 est égale à 3,4. La concentration en ion oxonium vaut [H3O+] = 10–3,4 = 4,0 × 10–2 mol.L–1.
Or [CH3COO–] = [H3O+] = 4,0 × 10–2 mol.L–1, ainsi α = [CH3COO–]/[CH3COOH]0 = 4,0 × 10–2/0,10 = 4,0 %.
L’acide éthanoïque réagit nettement plus en étant dilué 10 fois même si la réaction n’est pas totale.
Le coefficient de dissociation augmente rapidement avec la dilution :
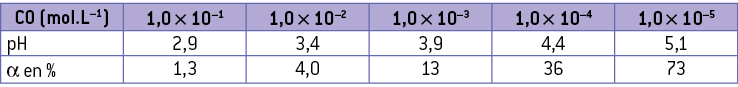
Pour montrer l’invariance de la valeur du pKa ou de la valeur de Ka d’un couple acide/base, on peut utiliser le coefficient de dissociation. On peut réaliser le protocole suivant à 25 °C, consistant à préparer des solutions d’acide éthanoïque de concentration 1,0 × 10–1, 1,0 × 10–2 et 1,0 × 10–3. La mesure du pH permet alors la détermination du coefficient de dissociation qui donne par calcul la valeur de la constante d’acidité Ka et du pKa du couple.

La valeur du pKa est bien constante, quelle que soit la concentration initiale en acide. Cette invariance peut aussi être mise en évidence avec la spectrophotométrie.
II. Les solutions tampon
On appelle solution tampon une solution constituée d’un mélange comportant des concentrations identiques ou proches d’un acide et de sa base conjuguée. Le pH d’une solution tampon est égal au pKa (ou en est très voisin) du couple considéré. Ainsi, pour obtenir une solution tampon d’un pH donné, il suffit de trouver un couple acide/base courant ayant un pKa proche de cette valeur cible et ensuite d’ajuster la proportion entre l’acide et la base pour avoir la bonne valeur de pH.
Exemple
Le couple acide éthanoïque/ion éthanoate CH3COOH/CH3COO– a un pKa = 4,8 : on pourra facilement préparer des solutions tampon dont le pH est compris entre 4,3 et 5,3.
Le pH d’une solution tampon varie peu lors d’un ajout d’une quantité modérée d’acide fort ou de base forte et ne varie pas lors d’une dilution.
Plusieurs liquides biologiques sont tamponnés, comme le sang ou les larmes :
- le pH moyen du sang vaut 7,4 à 37 °C. Il est tamponné par deux couples acido-basiques contenant des espèces carbonées ou phosphorées. Une variation de ce pH a des répercussions sur les réactions biochimiques ;
- le liquide lacrymal est aussi tamponné vers 7,4. Ce liquide humidifie constamment la cornée de l’œil. L’intérieur des cellules est aussi tamponné.
III. La solubilité du dioxyde de carbone
La valeur maximale d’exposition au CO2 est de 0,5 % dans l’air ambiant sur le lieu de travail, pendant une durée de travail quotidienne de 8 heures. Normalement, l’air ambiant contient environ 0,04 % de CO2. L’inhalation de concentrations de CO2 plus élevées provoque les symptômes suivants :
- à 1 % : légère accélération de la respiration ;
- à 2 % : la respiration devient plus profonde et jusqu’à 50 % plus rapide, avec des maux de tête et des signes de fatigue au bout de quelques heures ;
- à 3 % : la respiration devient difficile, le rythme respiratoire peut doubler. Les maux de tête se produisent rapidement, l’acuité auditive diminue, le pouls s’accélère et la tension artérielle augmente ;
- à 4-5 % : le rythme de la respiration s’accélère jusqu’à quadrupler ;
- à 5-10 % : l’odeur du CO2 est légèrement piquante. La respiration devient très difficile et on ressent un épuisement et des maux de tête ; la vue se brouille et les oreilles sonnent. La perte de conscience peut intervenir en l’espace de quelques minutes ;
Au-delà de 10 % : perte de conscience rapide pouvant conduire à la mort sans des soins d’urgence.
Le dioxyde de carbone est un gaz peu soluble dans l’eau neutre ou acide. Sa solubilité augmente dans les milieux basiques car c’est une espèce acide faisant partie du couple H2O, CO2/HCO3–. On note le dioxyde de carbone en solution H2O, CO2 et aussi parfois H2CO3, on lui donne alors le nom d’acide carbonique. Il contribue à l’acidification de l’atmosphère et des océans.
L’acidification des océans correspond à la baisse progressive du pH des océans liée particulièrement aux pollutions humaines. L’océan devient alors de plus en plus acide, ce qui perturbe l’écosystème océanique. Le pH de l’océan a diminué de 0,1 en une centaine d’années.
L’acidification est surtout causée par l’absorption de surplus de CO2 par les océans. Le dioxyde de carbone est massivement produit par les sociétés humaines depuis la révolution industrielle. Ue partie est absorbée par les plantes et les arbres, et un tiers est absorbée par les océans. Le CO2 se dissout progressivement dans l’eau et réduit le pH de l’eau.
Le dioxyde de carbone est un des gaz à effet de serre, qui contribue en raison de l’augmentation de sa concentration, à l’élévation de la température de l’atmosphère terrestre de surface et au dérèglement climatique.
