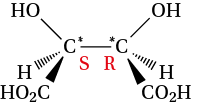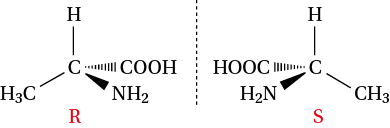Légende de la leçon
Vert : définitions
I. La représentation spatiale d’une molécule
On peut représenter des molécules dans l’espace avec la représentation de Cram :
- les liaisons dans le plan utilisent des traits fins :
- les liaisons en arrière du plan sont en pointillé :
- les liaisons en avant du plan sont un triangle plein :
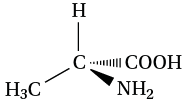
Ainsi, l’alanine, un acide aminé, est représentée de la façon suivante :
II. L’atome de carbone asymétrique
1) Définition
Un carbone est asymétrique s’il comporte 4 atomes ou groupes d’atomes différents. On le met en évidence en le marquant d’un petit astérisque : C*.
Tous les acides aminés, sauf le plus simple, la glycine, ont au moins un carbone asymétrique dans leur formule.
Exemple
Le carbone pointé de l’alanine porte : 1 H, 1 COOH, 1 CH3 et 1 NH2. Ces 4 groupes d’atomes sont différents donc ce carbone est asymétrique.
Il n’y a pas de carbone asymétrique dans la glycine car le carbone porteur de NH2 et de COOH est lié à deux H. Il n’y a donc pas 4 groupes d’atomes différents.
Il est possible de représenter en perspective une molécule ayant plusieurs atomes de carbone asymétriques, comme l’acide tartrique :
2) La configuration absolue d’un atome de carbone asymétrique
Pour chaque atome de carbone asymétrique, il existe deux possibilités de placer les quatre atomes ou groupes d’atomes différents. Pour enlever toute ambiguïté, on associe à chacune des deux une configuration absolue R ou S fondée sur les règles de Cahn, Ingold et Prelog (CIP) pour les carbones asymétriques :
- on détermine les quatre substituants de l’atome de carbone : pour l’acide tartrique, il y a deux carbones asymétriques, portant chacun les mêmes substituants : H, OH, CO2H, CHOHCO2H ;
- la priorité d’un substituant est donnée par le numéro atomique Z de l’atome directement lié, l’atome avec le numéro atomique le plus élevé ayant la priorité la plus importante. Lorsque deux substituants sont liés au carbone asymétrique par des atomes identiques, on étudie les substituants de ces atomes et on poursuit la comparaison dans les proximités suivantes de la ramification prioritaire. Ici, on a : OH (1), CO2H (2), CHOHCO2H (3) et H (4) ;
- on observe alors l’espèce chimique dans l’axe C*-substituant ayant la plus petite priorité (4). La configuration absolue est R (du latin rectus) si les substituants prioritaires « tournent » (1 puis 2 puis 3) dans le sens horaire, donc vers la droite. La configuration absolue S (du latin sinister) correspond à la rotation anti-horaire.
Exemple
Pour la molécule d’acide tartrique, le deuxième et le troisième atomes de carbone sont asymétriques et ont des configurations différentes : S et R. On l’écrit donc acide (2S, 3R) tartrique.
II. Les stéréoisomères
1) Les isomères de conformation
Deux molécules peuvent avoir la même formule semi-développée mais être non superposables (donc non identiques) : ce sont des stéréoisomères. Si on passe de l’une à l’autre par une simple rotation, ce sont alors des isomères de conformation.
Ainsi, l’éthane, de formule brute C2H6, de formule semi-développée CH3—CH3, comporte une infinité de conformations, dont deux particulières sont :
2) La chiralité
Nos deux mains ne peuvent pas se superposer l’une sur l’autre ; en revanche, elles sont symétriques l’une de l’autre par rapport à un plan ou dans un miroir plan. Nos deux mains sont chirales.
Une molécule A est chirale si son symétrique B par rapport à un plan ne lui est pas identique.
Une molécule comportant un seul atome de carbone asymétrique est chirale.
3) Les énantiomères
Deux molécules A et B symétriques l’une de l’autre par rapport à un plan mais qui ne sont pas superposables sont des énantiomères, il y a une relation d’énantiomérie entre les deux.
Une molécule comportant un seul atome de carbone asymétrique a deux énantiomères. Ainsi, l’alanine comporte un carbone asymétrique, elle a deux énantiomères :
Chaque énantiomère est chiral.
Remarques
« Énantiomère » est un terme réservé aux molécules et il nécessite deux molécules symétriques par rapport à un plan mais non identiques.
Le terme « chiral » concerne tous les objets ne comportant pas d’axe ou de plan de symétrie.
4) Les diastéréoisomères
Deux molécules A et B ayant la même formule semi-développée, qui ne sont pas des isomères de conformation non symétriques l’une de l’autre par rapport à un plan et non superposables, sont des diastéréoisomères, il y a une relation de diastéréoisomérie entre les deux. On obtient souvent des diastéréoisomères avec des molécules ayant une double liaison C=C ou avec plusieurs atomes de carbone asymétriques.
Pour qu’une molécule ayant une double liaison C=C conduise à des diastéréoisomères, il faut que chaque atome de carbone de la double liaison porte deux substituants différents. On attribue aussi une configuration absolue à chaque diastéréoisomère Z ou E en utilisant les règles CIP.
Remarques
Z signifie zusammen ou « ensemble » : les deux substituants prioritaires sont du même côté de la double liaison C=C.
E signifie entgegen ou « opposé » : les deux substituants prioritaires sont de part et d’autre de la double liaison.
Pour l’acide 3-chlorobut-2-ènoïque, on a ainsi :
5) Bilan : détermination de la stéréoisomérie