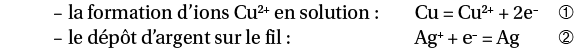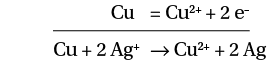I. La réaction d'oxydoréduction
1) Mise en évidence et définitions
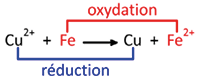
On plonge de la paille de fer (Fe) dans une solution d’ions cuivre (Cu2+). On effectue les observations suivantes :
- un dépôt de cuivre Cu se forme sur la paille, ce qui se note Cu2+ + 2 e– = Cu. C’est une réduction. On dit que les ions cuivre Cu2+ ont été réduits ;
- la solution se teinte en vert pâle, preuve de la formation des ions Fe2+, ce qui se note Fe = Fe2+ + 2 e–. C’est une oxydation. On dit que le métal fer Fe a été oxydé.
À savoir
Une réduction est un gain d’électrons.
Une oxydation est une perte d’électrons.
Dans cette expérience, l’équation de réaction s’écrit :
Les ions Cu2+ subissent une réduction. Elle est provoquée par le fer qui, en cédant des électrons, a un rôle réducteur.
Le fer subit une oxydation. Elle est provoquée par les ions Cu2+, qui, en gagnant des électrons, ont un rôle oxydant.
Cette réaction est appelée réaction d’oxydoréduction : il s’agit d’une réaction chimique au cours de laquelle il y a transfert d’électrons d’un réducteur vers un oxydant.
Cu2+/Cu et Fe2+/Fe sont des couples oxydant/réducteur, appelés aussi couples redox. Ox/Red désigne la paire composée par l’oxydant et le réducteur d’un même élément. La réaction d’oxydoréduction met en jeu l’oxydant du couple Cu2+/Cu et le réducteur du couple Fe2+/Fe.
De façon plus générale, une oxydoréduction met en jeu l’oxydant d’un couple et le réducteur d’un autre. L’équation de réaction s’écrit :
Ox1 + Red2 → Red1 + Ox2.
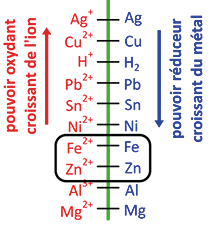
2) La classification des couples oxydant/réducteur
Expérience 1 : on plonge une lame de zinc Zn dans une solution d’ions fer Fe2+. On effectue les observations suivantes :
du fer se dépose sur la lame de zinc : Fe2+ + 2e– = Fe ;
des ions Zn2+, mis en évidence par un test à la soude, se forment en solution : Zn = Zn2+ + 2e– ;
l’équation de la réaction est donc : Zn + Fe2+ → Zn2+ + Fe.
Expérience 2 : on plonge une lame de cuivre Cu dans une solution d’ions fer Fe2+. Aucune réaction n’est observée.
On conclut de ces deux expériences que le zinc réduit les ions Fe2+, mais que le cuivre ne réduit pas les ions Fe2+. Le zinc est donc plus réducteur que le cuivre.
On peut ainsi établir une classification électrochimique plus complète des couples oxydant/réducteur (schéma ci-contre).
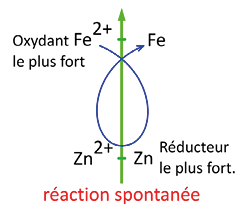
3) Le sens d’évolution spontanée
Une réaction d’oxydoréduction spontanée se fait entre le réducteur le plus fort et l’oxydant le plus fort des deux couples.
Pour prévoir les réactions spontanées, on utilise une classification électrochimique et la règle du « gamma » : on trace la lettre γ en partant de l’oxydant le plus fort et en allant vers le réducteur le plus fort.
Exemple
Zn réagit spontanément avec Fe2+.
4) Écrire l’équation de réaction d’une oxydoréduction
On plonge un fil de cuivre dans une solution d’ions argent. Les réactions sont :
En solution, tous les électrons donnés par le réducteur (Cu) sont transférés à l’oxydant (Ag+). Pour respecter cette propriété, on multiplie donc l’équation ➁ par 2 :
2 Ag+ + 2 e– = 2 Ag
II. La corrosion et la protection des métaux
1) Définition et mise en évidence
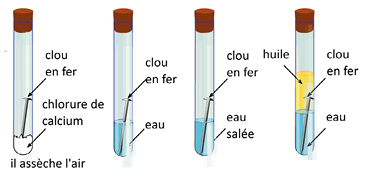
La corrosion est une dégradation d’un métal ou d’un alliage par oxydation due au dioxygène de l’air. Elle est favorisée par :
- l’eau ;
- le sel.
2) La passivation
Elle consiste en la formation d’une couche protectrice d’oxyde très résistante. Elle peut s’obtenir :
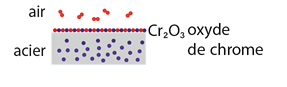
- naturellement : l’acier « inox », alliage de carbone (C) et de fer (Fe) à forte teneur en chrome (Cr), se recouvre au contact de l’air d’une couche de dioxyde de chrome (Cr2O3) qui le protège d’une oxydation poussée ;
- artificiellement : il existe des méthodes chimiques (passivation du fer par l’acide nitrique) ou électrochimiques (anodisation de l’aluminium) pour créer cette couche protectrice.
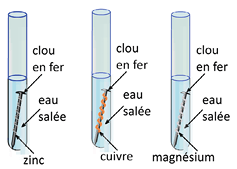
3) L’anode sacrificielle
Dans les 3 expériences ci-contre, seul le clou entouré de fil de cuivre subit une oxydation. Le zinc et le magnésium, plus réducteurs que le fer, s’oxydent à sa place.
Un métal peut donc être protégé de la corrosion s’il est en contact avec un métal plus réducteur que lui. C’est ce dernier qui subira la corrosion. Il constitue l’anode sacrificielle.