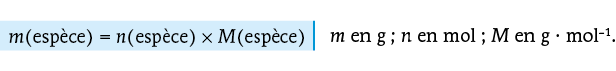La masse molaire d’une espèce est la masse d’une mole de cette espèce. Elle permet principalement d’associer deux grandeurs : la masse (facilement mesurable à l’aide d’une balance) et la quantité de matière (essentielle mais non mesurable directement).
I. Détermination d’une masse molaire
1) Masse molaire atomique
La mole est l’unité de quantité de matière, liée au nombre d’Avogadro 𝒩A. Dans une mole d’atomes, il y a 6,02 × 1023 atomes, avec 𝒩A = 6,02 × 1023 mol−1. Dans un échantillon contenant N atomes, on a donc n mol d’atomes avec :
N = n × 𝒩A
Par analogie, on peut raisonner avec les masses. La masse molaire d’un atome est la masse d’une mole de cet atome : c’est le produit de la masse d’un atome par le nombre d’Avogadro :
M (atome) = m(1 atome) × 𝒩A
Les masses molaires atomiques sont indiquées dans le tableau périodique des éléments.
2) Masse molaire moléculaire
La masse molaire moléculaire est la masse d’une mole de molécules. Elle se calcule en « décomposant » la molécule en atomes qui la constituent.
(Pour voir l'intégralité des lignes écrites, privilégier le mode paysage pour le smartphone)
Exemple : M(C2H4)=2×M(C)+4×M(H)=2×12,0+4×1,0=28,0 g · mol–1
À noter
Attention aux chiffres significatifs ! Chaque masse molaire atomique est souvent donnée à 0,1 g · mol−1 près : la masse molaire moléculaire sera donc aussi à donner à 0,1 g · mol−1 près.
3) Masse molaire ionique
La masse d’un atome étant très majoritairement concentrée dans son noyau, la masse d’un atome sera très proche de la masse de l’ion correspondant.
Donc la masse molaire d’un ion est presque égale à la masse molaire de l’atome.
Exemple : M(Na+) ≈ M(Na) et M(Cr2O72–) ≈ 2 × M(Cr) + 7 × M(O)
II. Relation entre la masse et la quantité de matière
Méthodes
1) Calculer une masse molaire moléculaire
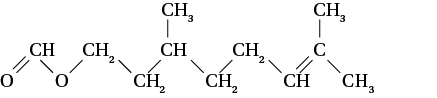
La rose doit son parfum délicat à une molécule de formule semi-développée :
Conseils
Trouvez d’abord la formule brute de cette molécule, puis écrivez la masse moléculaire de la molécule en fonction des masses moléculaires atomiques et du nombre de chaque atome dans la molécule.
Déterminer la masse moléculaire de cette molécule.
Données : quelques masses molaires atomiques :
M(H) = 1,0 g · mol−1 ; M(C) = 12,0 g · mol−1 ; M(O) = 16,0 g · mol−1.
Solution
La formule brute de cette molécule est : C11H20O2.
Donc : M(C11H20O2) = 11 × M(C) + 20 × M(H) + 2 × M(O)
= 11 × 12,0 + 20 × 1,0 + 2 × 16,0 = 184,0 g · mol–1.
2) Déterminer une quantité à partir d’une masse
On considère un bloc de charbon, de masse m = 1,85 kg. Le charbon est un corps constitué uniquement d’atomes de carbone.
a. Calculer la quantité de matière en atomes de carbone dans ce bloc de charbon.
b. Calculer le nombre d’atomes de carbone présents dans ce bloc de charbon.
Conseils
a. Utilisez la relation liant la masse à la quantité de matière, mais attention aux unités : la masse doit être exprimée en grammes.
Solution
a. Dans le tableau périodique des éléments, on trouve la masse molaire atomique du carbone : M(C) = 12,0 g · mol−1.
On a : n(C)=m(bloc de charbon)M(C)=1,85×10312,0=154 mol.
b. Nombre d’Avogadro : 𝒩A = 6,02 × 1023 mol−1.
N(C) = n(C) × 𝒩A = 154 × 6,02 × 1023 = 9,28 × 1025. Ce bloc de charbon contient le nombre (extraordinairement grand !) de 9,28 × 1025 atomes de carbone.