La respiration cellulaire
La respiration cellulaire est une réaction productrice d’énergie qui se déroule majoritairement au niveau des mitochondries. Elle consiste en la dégradation de glucose (C6H12O6), en présence de dioxygène, avec libération de dioxyde de carbone et d’eau :
Remarque
Une partie de l’énergie produite par la respiration cellulaire est dissipée sous forme de chaleur, assurant le maintien de la température corporelle.
Les échanges gazeux
Les gaz dissous se déplacent d’un milieu à un autre par diffusion selon leur gradient de pression partielle (Pp), du milieu où la Pp est la plus forte vers celui où elle est la moins forte, jusqu’à équilibre de leurs pressions partielles.
À savoir
La pression partielle d’un gaz est la pression exercée par celui-ci dans un mélange gazeux. Seule la fraction dissoute d’un gaz participe à la pression partielle, qui est proportionnelle à sa quantité dans le mélange.
A) Au niveau pulmonaire
Le O2 dissous diffuse de l’air alvéolaire vers le sang, tandis que le CO2 dissous diffuse dans le sens inverse. Ceci constitue l’hématose, c’est-à-dire le passage du sang d’un état riche en CO2 à un état riche en O2. Le sang qui quitte les poumons et rejoint le cœur par les veines pulmonaires est dit hématosé.
B) Au niveau tissulaire
Le O2 dissous diffuse du sang vers les cellules, tandis que le CO2 dissous diffuse des cellules vers le sang.
À savoir
L’état du sang ne change pas lors de son parcours entre les cellules et les alvéoles pulmonaires, c’est-à-dire que les pressions partielles en O2 et CO2 dans le sang ne varient pas entre les poumons et les tissus.
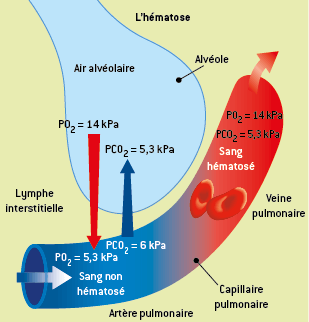
Les échanges gazeux pulmonaires

Les échanges gazeux tissulaires
Le transport sanguin des gaz respiratoires
A) Le transport du dioxygène
a) Les différentes formes de transport du dioxygène
Le dioxygène est transporté sous 2 formes dans le sang :
majoritairement combiné à l’hémoglobine (Hb) dans les hématies (98 %) ;
en faible quantité dissous dans le plasma et le cytoplasme des hématies (2 %).
L’hémoglobine est un pigment respiratoire présent exclusivement dans les hématies. Il est formé de 4 chaînes polypeptidiques appelées globine avec un hème au centre de chacune. L’hème est une molécule non protéique contenant un atome de fer sous forme Fe2+ qui peut fixer de façon réversible une molécule de O2.

Schéma d’une molécule d’hémoglobine
À savoir
On parle d’anémie quand le taux sanguin en hémoglobine diminue.
Équation de fixation du dioxygène sur l’hémoglobine :
Au niveau des poumons, l’hémoglobine se charge en O2 (sens 1 de la réaction). Elle peut fixer de 1 à 4 molécules de O2 dissous ; quand elle est liée à 4 molécules d’O2, elle est dite saturée et est appelée oxyhémoglobine.
Au niveau des tissus, l’hémoglobine se décharge partiellement en O2 (sens 2 de la réaction). Le O2 libéré (1 à 2 molécules O2, le plus souvent) se retrouve à l’état dissous dans le sang et diffuse dans les cellules selon son gradient de pression.
b) La modulation de la prise en charge du dioxygène par l’hémoglobine
L’affinité de l’hémoglobine pour le O2, c’est-à-dire sa capacité à fixer celui-ci, varie en fonction de la PpO2. La courbe présentant le pourcentage de saturation de l’hémoglobine en O2 en fonction de la PpO2 montre que la saturation augmente avec la PpO2, mais de façon non proportionnelle.
À savoir
La saturation de l’hémoglobine en O2 (SaO2) est le rapport du taux d’oxyhémoglobine sur l’hémoglobine totale.

Courbe de saturation de l’hémoglobine en fonction de la PO2
À forte PpO2 (au niveau alvéolaire, avec PpO2 = 14 kPa), l’hémoglobine présente une forte affinité pour le O2 : il y a donc une prise en charge maximale du O2 par l’hémoglobine (98 % de Hb(O2)4).
À faible PpO2 (au niveau cellulaire, avec PpO2 = 4 kPa), l’hémoglobine présente une faible affinité pour le O2 (60 % de Hb(O2)4) : il y a dissociation de l’oxyhémoglobine (98-60 = 38 % dissociée) et libération du O2 qui se retrouve à l’état dissous et diffuse dans les cellules.
À SAVOIR
À failble PO2, la pente de la courbe est forte, ce qui signifie qu’une faible diminution de la PpO2 entraîne une forte dissociation de l’oxyhémoglobine et donc une augmentation de la libération du O2. Ainsi, lors d’un effort physique, la respiration cellulaire étant plus importante au niveau des muscles pour augmenter la production d’énergie, la PpO2 cellulaire diminue (3 kPa par exemple). Ceci favorise la dissociation de l’oxyhémoglobine et la diffusion du O2 dans les cellules musculaires, ce qui répond à leurs besoins accrus en O2.
B) Le transport du dioxyde de carbone
Le CO2 est transporté dans le sang sous 3 formes :
dissous dans le plasma et le cytoplasme des hématies (5-10 %) ;
combiné à l’hémoglobine (30 %) ;
combiné à l’eau (plasma, cytoplasme des hématies) sous forme d’ions hydrogénocarbonates HCO3– (60 %).
À savoir
Le dioxygène et le dioxyde de carbone transportés sous forme combinée doivent d’abord se dissocier de leur transporteur pour se retrouver à l’état dissous et diffuser.
Lorsque le CO2 se combine à l’eau, il y a libération d’ions H+, ce qui conduit à une baisse du pH sanguin.
Les facteurs modulant l'affinité de l'hémoglobine pour le dioxygène
La température, le pH et le CO2 sont des facteurs physiologiques susceptibles de modifier l’affinité de l’hémoglobine pour le O2. Lors d’une activité physique, l’augmentation de la respiration cellulaire au niveau des muscles entraîne une augmentation de la température, de la PpCO2 et une baisse du pH. Ces facteurs interagissent pour favoriser la dissociation de l’oxyhémoglobine (courbe décalée vers la droite) et donc la libération des molécules de O2 et leur diffusion dans les cellules musculaires. Ainsi, les cellules sont mieux alimentées en O2, ce qui répond à l’augmentation de leurs besoins lors de l’exercice musculaire.

La modulation de la saturation de l’hémoglobine en fonction de la PpCO2, de la température ou du pH

L’incidence de l’activité physique sur la libération
de dioxygène au niveau tissulaire

