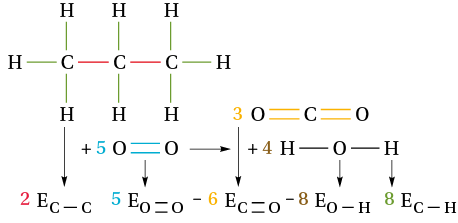I. Le diagramme d’état d’un corps pur
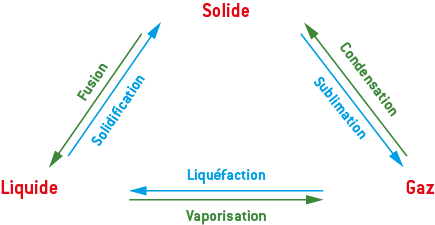
1) Les changements d’état
Le changement d’état d’un corps est une transformation physique au cours de laquelle le corps passe d’un état physique à un autre.
Un corps pur est un corps constitué d’une seule espèce chimique, contrairement à un mélange. Sous une pression donnée, le changement d’état d’un corps pur se fait à une température constante, caractéristique de ce corps pur. Cette température est appelée température de changement d’état.
Exemple
Pour l’eau, sous une pression de 1,0 bar, θfus = 0,0 °C et θvap = 100 °C.
2) Les diagrammes d’état
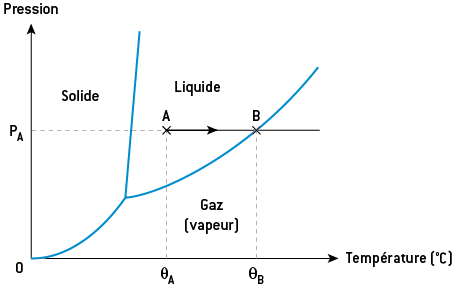
Connaissant sa température et sa pression, on peut prévoir l’état physique d’un corps pur en utilisant son diagramme d’état. Le diagramme d’état d’un corps pur est une représentation graphique en deux dimensions (pression en fonction de la température). Les trois lignes représentent les frontières entre l’état solide, l’état liquide et l’état gazeux.
Exemple
On considère un corps pur dont on propose le diagramme d’état ci-contre. Il est initialement à la pression PA et à la température θA. D’après le diagramme, ce corps pur est à l’état liquide. On le chauffe à pression constante. Sa température augmente jusqu’au point B situé à la frontière entre l’état liquide et l’état gazeux. Au point B, le corps se vaporise à la température θB, qui est la température de vaporisation de ce corps pur à la pression PA. Dès lors, si l’on poursuit le chauffage, le corps pur est entièrement à l’état gazeux et sa température augmente.
3) L’enthalpie de changement d’état
Pendant un changement d’état de l’état 1 vers l’état 2, à pression constante, l’enthalpie ΔH (ou l’énergie thermique échangée) avec le milieu extérieur par une masse m d’un corps pur est égale au produit de la masse m de corps pur par l’enthalpie molaire de changement d’état Δ1→2H du corps pur :
Remarque
Il faut préciser le changement d’état considéré : le corps pur reçoit de l’énergie (Δ1→2H > 0) lors d’une fusion, d’une vaporisation ou d’une sublimation (passage vers un état moins organisé). Inversement, le corps pur cède de l’énergie (Δ1→2H < 0) lors d’une condensation, d’une liquéfaction ou d’une solidification (passage vers un état plus organisé).
ΔS→LH = –ΔL→SH ΔL→GH = –ΔG→LH ΔS→GH = –ΔG→SH
Exemple
On fait fondre une masse m = 45 g de glaçons à 0 °C. ΔS→LH = 334 kJ.kg–1.
La masse vaut m = 0,045 kg, ainsi les glaçons vont recevoir une énergie ΔH = m × ΔS→LH = 0,045 × 334 = 15 kJ.
4) La variation d’enthalpie lors d’une variation de température
L’enthalpie d’une phase condensée varie lorsque la température passe de la température initiale Ti à la température finale Tf. Cette variation est proportionnelle à la différence de température (Tf – Ti), à la masse m de phase condensée et à la capacité thermique massique c de la phase condensée (plus c est grande, moins la variation de température est élevée pour une même masse).
Lors d’une élévation de température, la phase condensée voit son enthalpie augmenter.
Exemple
L’eau produite par la fonte des glaçons à 0 °C voit son enthalpie augmenter de 3,0 kJ. ceau = 4,2 J.g–1.K–1.On peut alors calculer la température finale de l’eau. La formule ΔH = m × ceau × (Tf – Ti), permet d’écrire (Tf - Ti) = ΔH/m × ceau soit Tf = Ti + ΔH/m × ceau = 0 + 3,0 × 103/(45 × 4,2) = 16 °C.
Remarque
Lorsqu’un corps reçoit de l’énergie thermique du milieu extérieur, son enthalpie augmente, ce qui se traduit soit par une élévation de température, soit par un changement d’état, soit par une élévation de température et un changement d’état.
II. Les enthalpies standards
1) L’enthalpie standard de formation d’un corps pur ΔHf0
Un corps pur simple est un corps pur ne comportant qu’un seul élément chimique : le graphite C, le dihydrogène gazeux H2, etc. Un corps pur composé en comporte plusieurs : CO2, H2O, C2H6O, etc.
L’état standard d’un composé chimique pur est défini sous la pression standard : p° = 1 bar = 105 Pa.
L’enthalpie standard de formation ΔHf0(T) à la température T d’un corps pur est la différence d’enthalpie mise en jeu lors de la formation d’une mole de ce corps pur à partir des corps purs simples, considérés dans l’état standard, stables à la température considérée T. L’enthalpie standard de formation ΔHf0(T) s’exprime en joule par mole (J.mol–1).
Exemple
L’enthalpie standard de formation à T de l’eau liquide H2O (l) est la variation d’enthalpie lors de la réaction de formation à partir du dioxygène et du dihydrogène gazeux dans l’état standard à T :
H2 (g)+ ½ O2 (g)→ H2O (l).
Remarque
L’enthalpie standard de formation d’un corps simple stable, à la température T, est nulle.
Ainsi, l’enthalpie de formation du graphite, ΔHf0(T) (Cgraphite), la forme stable du carbone, est nulle à 298 K ; en revanche, celle du carbone diamant ne l’est pas puisque ce n’est pas la forme stable du carbone dans les conditions standards à 298 K.
2) L’enthalpie standard de réaction ∆Hr0 et la loi de Hess
L’enthalpie standard de réaction ΔHr0 est l’énergie libérée ou prélevée au milieu extérieur par une réaction dans l’état standard.
Si la valeur de l’enthalpie standard de réaction ΔHr0 est :
- positive, le système chimique reçoit de l’énergie du milieu extérieur, la réaction est endothermique ;
- négative, le système chimique cède de l’énergie au milieu extérieur, la réaction est exothermique ;
- nulle, le système chimique ne reçoit pas d’énergie du milieu extérieur ni ne lui en cède, la réaction est athermique.
L’enthalpie standard de réaction ΔHr0 est déterminée à partir des enthalpies standards de formation ΔHf0 des réactifs et des produits de la réaction et de leurs coefficients stœchiométriques. Si une réaction chimique s’écrit a A + b B → c C + d D, alors : ΔHr0 = (d ΔHf0(D) + c ΔHf0(C)) – (a ΔHf0(A) + b ΔHf0(B)) : c’est la loi de Hess
Remarque
L’enthalpie standard ΔHf0 de formation d’un corps pur est l’enthalpie standard de réaction à partir des corps simples stables dans l’état standard.
Exemple
L’équation de combustion du propane est : C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (g).
ΔHf0(CO2 (g)) = –394 kJ.mol–1, ΔHf0(H2O(g)) = – 242 kJ.mol–1, ΔHf0(C3H8 (g)) = 104 kJ.mol–1 et ΔHf0(O2 (g)) = 0 kJ.mol–1.
ΔHr0 = (3 ΔHf0(CO2 (g)) + 4 ΔHf0(H2O(g))) – (ΔHf0(C3H8 (g)) + 5 ΔHf0(O2 (g)))
= (3 × (–394) + 4 × (–242)) – (–104 + 5 × 0) = –2,05 × 106 J.mol–1 = 2,05 MJ/mol.
3) L’énergie de liaison

En phase gazeuse, la dissociation d’une liaison chimique AB conduit aux atomes A et B isolés :
AB (g) → A (g) + B (g).
Cette dissociation nécessite de l’énergie : c’est l’énergie de liaison, notée EA-B ou Em,A-B, exprimée en joule par mole (J.mol–1).
Les valeurs des énergies de liaisons que l’on trouve dans les tables sont des moyennes car la force d’une liaison dépend aussi des autres liaisons établies par les atomes liés.
L’enthalpie standard de combustion ΔHr0est négative puisque les combustions sont exothermiques. Elle peut être calculée de manière assez précise à partir des liaisons rompues et formées au cours de la combustion : c’est la somme des énergies des liaisons rompues moins la somme des énergies des liaisons formées : ΔHr0 = Σ Eliaisons rompues – Σ Eliaisons formées.
Exemple
L’équation de combustion du propane est : C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (g).
Au cours de cette combustion, 5 liaisons O=O, 2 liaisons C–C et 8 liaisons C–H sont rompues, tandis que 6 liaisons C=O et 8 liaisons O–H sont formées. L’énergie molaire de réaction est :
ΔHr0 = (5 EO =O + 2 EC–C + 8 EC–H) – (6 EC=O + 8 EO–H) = (5 × 498 + 2 × 345 + 8 × 415) – (6 × 804 + 8 × 463) = –2,0 × 103 kJ.mol–1 = –2,0 MJ/mol.
On retrouve le résultat déterminé à partir des enthalpies de formation.
III. L’énergie produite par une combustion
1) Le pouvoir calorifique d’un combustible

Le pouvoir calorifique massique d’un combustible, noté PC, est l’énergie dégagée par la combustion complète d’un kilogramme de combustible. Il s’exprime en joule par kilogramme (J.kg–1).
On parle de pouvoir calorifique supérieur (PCS) si l’eau produite par la combustion est à l’état liquide. Dans le cas où l’eau formée est à l’état de vapeur, il s’agit du pouvoir calorifique inférieur (PCI).
2) Enthalpie de réaction d’une combustion
L’enthalpie de réaction d’une combustion ΔHr mettant en jeu une masse m de combustible est calculée à partir du pouvoir calorifique massique du combustible mis en jeu : la valeur de Elib est positive car PC est toujours positif par convention.
Remarque
Dans le cas d’un corps pur, l’enthalpie standard de combustion ΔHr0 (J.mol–1) et le pouvoir calorifique PC (J.kg–1) sont liés par la relation : |ΔHr0| = M × PC, où M est la masse molaire du combustible en kilogramme par mol (kg.mol–1). Il faut placer une valeur absolue autour de l’enthalpie standard de combustion car le pouvoir calorifique est positif.
3) Détermination du pouvoir calorifique d’un combustible
Il faut peser un brûleur à alcool rempli d’alcool (m0 = 160 g) et l’utiliser pour faire chauffer un bécher contenant de l’eau, le total ayant une masse m = 300 g.
On relève aussi la température de l’eau avant chauffage : θi, puis on fait chauffer l’eau jusqu’à obtenir une augmentation de température de l’eau de 30 °C. θf = θi + 30.
On arrête le chauffage et on pèse alors le brûleur : m1 = 157 g. La masse malcool d’alcool qui a brûlé est donc malcool = m1 – m0 = 3,0 g.
La réaction subie par l’éthanol est une combustion, c’est une réaction exothermique.
L’équation de la réaction de l’éthanol avec le dioxygène de l’air est :
C2H6O + 3 O2 → 2 CO2 + 3 H2O.
L’énergie produite par cette réaction a pu chauffer l’eau et le bécher.
On appelle ΔHr l’enthalpie de combustion de l’alcool : c’est l’opposé de ΔHeau + bécher l’enthalpie reçue par l’eau et le bécher sous forme thermique. Elib = –Qeau + bécher.
Sachant que la capacité thermique massique de l’eau est ceau = 4,2 J.g–1.°C–1, la valeur de ΔHeau + bécher = m.ceau.(θf – θi) = 300 × 4,2 × 30 = 3,8 × 104 J.
Cette énergie provient de la combustion, l’enthalpie de combustion de l’alcool est donc ΔHr = –3,8 × 104 J.
En supposant que l’alcool est exclusivement constitué d’éthanol, on détermine la valeur de l’enthalpie massique de combustion par gramme d’éthanol lors de sa combustion en divisant la valeur précédente par la masse d’éthanol qui a brûlé : ΔHr/malcool = – 1,3 × 104 J.g–1.
Le pouvoir calorifique massique PC est la valeur absolue de l’enthalpie massique d’un kilogramme de combustible (le pouvoir calorifique est positif), soit 1 000 fois plus que la valeur précédente, soit PCéthanol = 1,3 × 107 J.kg–1 = 13 MJ.kg–1. On trouve environ la moitié de la valeur théorique. Ce résultat est bon malgré tout, car il y a beaucoup de pertes thermiques au cours de la manipulation.