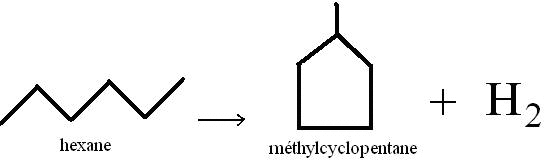I. Molécules de la chimie organique
Bon nombre de notions ont déjà été abordées en classe de première (à connaître donc !). Si les plus importantes sont rappelées dans la présente fiche, il est fortement recommandé d'aller réviser la fiche suivante :
Structure des entités organiques
1. Notion de chimie organique
Définition :
Les molécules de la chimie organique sont principalement constituées des éléments carbone () et hydrogène ().
Ces molécules peuvent également renfermer de l'oxygène (), de l'azote (), voire certains halogènes (tel que le chlore ).
Ce sont des molécules dont les atomes sont liés par des liaisons covalentes.
Historiquement : composé du vivant.
Actuellement : composé de carbone () (sauf , , etc.) avec de l'hydrogène (),
de l'oxygène () et/ou de l'azote ().
Cette forme de chimie sert à analyser et à synthétiser les corps organiques.
2. Groupes caractéristiques et famille chimique
Pour savoir comment trouver la valence des atomes, il est nécessaire de réviser la fiche suivante :
De la structure à l'électronégativité des entités et à la polarité des molécules
Rappel : une liaison covalente est une mise en commun de deux électrons de la couche externe.
Cas de l'atome de carbone :
Son numéro atomique est , ce dernier a donc électrons, répartis de la façon suivante : () ; ce dernier a donc électrons de valence.
Pour satisfaire à la règle de l'octet, l'atome de carbone doit donc compléter sa dernière sous-couche () avec électrons en mettant en commun ses quatre électrons de valence avec d'autres atomes : il est tétravalent.
Remarque : un hydrocarbure saturé ne contient que des atomes de carbone tétragonaux. Sinon, il est insaturé.
Une molécule organique, autre que celle d'un hydrocarbure, est constituée :
Du squelette carboné (c'est-à-dire de l'enchaînement des atomes de carbone constituant la molécule), ne comportant que du carbone et de l'hydrogène ;
D'un ou plusieurs groupe(s) caractéristique(s) comptant au moins un atome autre que et (par exemple , , , etc.).
Groupe caractéristique et famille chimique :
Un groupe caractéristique est un groupe d'atomes qui donne des propriétés spécifiques aux molécules qui le possèdent.
On dit que ces molécules (ayant le même groupe caractéristique) forment une famille chimique.
3. Formules chimiques
Formule brute :
La formule brute d'une molécule organique indique les atomes la constituant et leurs quantités respectives.
Exemple : la formule brute du butane s'écrit .
Formule semi-développée plane :
La formule semi-développée d'une molécule organique indique les atomes la constituant sans leurs doublets et les liaisons avec les atomes d'hydrogène () ne sont pas représentées.
Exemple : la formule semi-développée du butane s'écrit .
Formule topologique :
La formule topologique représente la chaîne carbonée par une ligne brisée. Chaque extrémité de segment représente un atome de carbone portant autant d'atomes d'hydrogène qu'il est nécessaire pour satisfaire à la règle de l'octet. Les atomes autres que sont représentés de manière explicite ainsi que les atomes d'hydrogène qu'ils portent (par exemple un groupement ).
Exemple : (le butane) se représente de la manière suivante sous forme topologique :
Remarque : il existe d'autres manières d'écrire les formules chimiques des molécules organiques :
Formule de Lewis (vue en classe de 1re) : on y voit les atomes ainsi que leurs doublets liants et non-liants ;
Formule développée plane : elle est identique à la formule de Lewis, mais les doublets non-liants ne sont pas visibles. Elle précise la nature et l'ordre d'enchaînement des liaisons entre les différents atomes d'une molécule.
4. Règles de nomenclature
Ces dernières ont été vues en classe de première, il est donc primordial de savoir exploiter des règles de nomenclature fournies pour nommer une espèce chimique ou représenter l’entité associée :
Structure des entités organiques
5. Structure, électronégativité et polarité d'une molécule
Ces notions ont également été introduites dans cette fiche en classe de première et sont donc également applicables pour les molécules organiques :
De la structure à l'électronégativité des entités et à la polarité des molécules
II. Les chaînes carbonées saturées et insaturée
1. Les chaînes carbonées saturées (cycliques ou non)
Ces dernières ont été vues en classe de première, il est donc fortement recommandé de réviser la fiche suivante :
Structure des entités organiques
2. Les chaînes carbonées insaturées
Chaîne carbonée insaturée :
Lorsqu'une molécule comporte au moins une double liaison, on dit qu'elle est insaturée.
Remarque :
Les liaisons multiples sont dites insaturées (liaisons doubles ou triples).
Les chaînes carbonées insaturées contiennent donc au moins une liaison insaturée.
Définition :
Les alcènes sont des hydrocarbures qui renferment une ou plusieurs liaison(s) double(s) (que la chaîne carbonée soit linéaire ou ramifiée) et ayant pour formule brute .
Nomenclature : on considère le nom de l'alcane correspondant (c'est-à-dire le même squelette carboné mais sans double liaison) pour lequel on remplace "ane" par "ène". Il faut repérer l'emplacement de la double liaison et le numéro du premier atome de carbone qui la porte. On intercale le numéro de ce carbone entre le radical et le suffixe "ène".
Exemples :
est le but-1-ène ;
est le but-2-ène ;
Quelques molécules à nommer grâce à leurs formules topologiques :
Molécule 1 | Molécule 2 | Molécule 3 |
|---|---|---|
2-méthylpent-2-ène | cyclohexène | 2,3-diméthylbut-2-ène |
Définition :
Les alcynes sont des hydrocarbures possédant une ou plusieurs liaison(s) triple(s).
Nomenclature : idem que pour les alcènes, mais l'on change "-ène" en "-yne".
Exemple :
III. Les familles de molécules oxygénées
1. Rappels de première
Son numéro atomique est , ce dernier a donc électrons, répartis de la façon suivante : () ; ce dernier a donc électrons de valence.
Pour satisfaire à la règle de l'octet, l'atome de carbone doit donc compléter sa dernière sous-couche () avec électrons en mettant en commun ses deux électrons de valence avec d'autres atomes : il est divalent. Il peut donc établir liaisons covalentes : soit avec deux atomes différents, soit avec le même atome (liaison double).
Les familles de molécules oxygénées vues en 1re sont les alcools, les aldéhydes, les cétones et les acides carboxyliques :
Structure des entités organiques
2. Nouvelles familles de molécules oxygénées
Le §I. a pu rappeler qu'un groupe caractéristique est un groupe d'atomes qui donne des propriétés spécifiques aux molécules qui le possèdent, formant entre elles une famille chimique.
Il existe d'autres familles de molécules oxygénées non vues en classe de 1re : les halogénoalcanes, les amines, les amides et les esters.
Les halogénoalcanes sont des molécules qui contiennent au moins un groupe caractéristique halogéno , étant un atome de la famille des halogènes : (fluor), (chlore), (brome) ou (iode).
Exemple : le dichlorométhane
Test caractéristique : on utilise une solution de nitrate d'argent. Si on se trouve en présence d'un composé halogéné, on obtient alors un précipité d'halogénure d'argent.
Nomenclature : on rajoute préfixe "fluoro", "chloro", "bromo" ou "iodo" au nom de l'alcane dont il dérive.
Les amines sont des molécules qui contiennent le groupe caractéristique amino . Il s'agit de composés azotés dérivant de l'ammoniac par remplacement d'un ou plusieurs atomes d'hydrogène par des groupes carbonés.
Les amines à chaîne carbonée saturée ont pour formule générale .
Par analogie avec les alcools, la classe de l'amine est définie par le nombre d'atomes d'hydrogène liés à l'azote : on distingue ainsi les amines primaires (I), secondaires (II) et tertiaires (III).
Exemples :
Le méthanamine est une amine I : ;
Le N-méthylméthanamine est une amine II : ;
Le triméthylamine de formule est une amine III :
Test caractéristique : test de (ce sont des espèces basiques en solution aqueuse). Elles font partie des couples acido-basiques ion alkylammonium / amine ( / ). Elles réagissent avec l'eau selon l'équation :
Ce sont les ions hydroxyde les responsables de la basicité en solution aqueuse.
Nomenclature : leur nom officiel s'obtient en remplaçant le "e" final de l'alcane dont il dérive par le suffixe amine. Une nomenclature plus courante (nomenclature radico-fonctionnelle) consiste à ajouter le suffixe amine au nom du radical après en avoir supprimé le "e" final.
Remarque : la fonction amine recouvre un ensemble très étendu de composés, par exemple :
Les acides aminés comme l'acide 2-aminopropanoïque également appelé alanine ;
Les alcaloïdes comme la caféine :
Les amides sont des molécules qui contiennent un groupe caractéristique amino lié à un groupe carbonyle .
Les amides à chaîne carbonée saturée ont pour formule générale .
Par analogie avec les amines, la classe de l'amide est définie par le nombre d'atomes d'hydrogène liés à l'azote : on distingue ainsi les amides primaires (I), secondaires (II) et tertiaires (III).
Nomenclature : un amide dérive de celui de l’acide carboxylique de même chaîne carbonée. La terminaison finale « oïque » de l’acide est remplacée par la terminaison « amide » et le mot « acide » est supprimé.
Les esters sont des composés organiques de formule semi-développée , où et sont deux groupements alkyle de la forme .
La chaîne carbonée principale correspond à .
La formation d'un ester (transformation dite d'estérification) se fait à partir d'un acide carboxylique et d'un alcool :
Exemple :
Nomenclature : le nom de l'ester est composé :
Du nom de l'acide carboxylique suivi du terme "oate" ;
Du nom de l'alcool suivi du terme "yle".
Schématiquement l'appellation de l'ester correspond à de .
Exemple : le propanoate de méthyle est l'ester de l'acide propanoïque et du méthanol.
Test caractéristique : on utilise une solution de soude (hydroxyde de sodium). Si on se trouve en présence d'un ester, on obtient alors un précipité d'acide carboxylique et d'alcool.
Remarque : les esters sont des composés très utilisés dans l'industrie alimentaire, cosmétique et pharmaceutique.
IV. Isomérie de constitution
1. Notion d'isomérie
Des molécules sont dites isomères si elles sont différentes mais ont des formules brutes identiques.
Remarque : les molécules de deux isomères ne sont pas superposables.
2. Les isomères de constitution
Des isomères de constitution ont la même formule brute mais des formules planes différentes (les squelettes carbonés sont différents).
On distingue plusieurs types d'isomères de constitution :
Les isomères de chaîne : seul le squelette carboné change. Par exemple : .
Les isomères de position où un groupe caractéristique ou une instauration occupe une position différente sur un squelette carboné inchangé. Par exemple : .
Les isomères de fonction pour lesquels le groupe caractéristique diffère. Par exemple, l'éthanol et l'étheroxyde .
V. Modifications du squelette carboné
1. Les réactions d'addition
Dans ce type de réaction, la double liaison plane est remplacée par une liaison simple.
L'atome de carbone est alors tétraédrique et le nombre d'atomes de carbone composant la chaîne carboné n'est pas modifié.
Deux substituants vont se fixer sur le réactif insaturé de la réaction. Ces substituants sont issus de la scission en deux parties de la molécule d'un autre réactif.
Exemple : en présence d'un catalyseur, sous pression et à chaud :
est le réactif insaturé et le dihydrogène est la molécule se coupant.
2. La polymérisation (ou polyaddition)
La polymérisation est une technique consistant en une addition répétée d'un très grand nombre de molécules insaturées appelées monomères. Cette opération conduit à la formation d'une macromolécule appelée polymère :
est appelé indice de polymérisation ;
Le groupe est le motif du polymère.
Les monomères peuvent être des composés vinyliques du type suivant: CH-CHA. Ils présentent alors un groupe vinyle : .
Les polymères résultants seront donc de la forme : .
Exemples :
L'éthylène conduit à la formation du polyéthylène (PE) servant à la fabrication des emballages d'aliments, films plastiques, flacons, bidons, etc.
Le chlorure de vinyle à pour polymère correspondant le polychlorure de vinyle (PVC) utilisé entre autres pour les tuyaux et les canalisations ;
Le styrène donnera le polystyrène (PS) présents dans les réfrigérateurs, pour la protection des emballages, etc.
3. Pour aller plus loin : autres réactions intervenant dans le raffinage des pétroles
Ces réactions sont utilisées afin de valoriser les produits résultant de la distillation fractionnée des pétroles. Il s'agit d'un exemple industriel qui n'est pas à connaître.
Selon la température, le pétrole emmagasiné n'est pas transformé de la même manière. Il existe alors une sorte d'échelle de distillation.
Les différents hydrocarbures contenus dans le pétrole sont séparés dans des raffineries par distillation fractionnée : le pétrole est chauffé jusqu'à . Les composés organiques gazeux à faibles températures d'ébullition sont évacués en haut de la colonne. Les composés au squelette carboné plus important, qui ont une grande température d'ébullition, sont récupérés en bas de la colonne.
C'est une opération au cours de laquelle les molécules d'hydrocarbures saturés à longues chaînes sont cassées par l'agitation thermique pour produire des molécules à chaînes plus courtes.
Il existe plusieurs types de craquage :
Le craquage catalytique : se produit en présence d'un catalyseur (une substance accélérant la réaction sans subir de modifications permanentes et sans influer sur le bilan de la réaction) ;
Le vapocraquage (ou hydrocraquage) : la rupture des molécules se fait en présence de vapeur d'eau.
Exemples :
Le craquage de l'hexane : ici, l'hexane initial a été brisé en deux parties : du but-1-ène et de l'éthane. En additionnant ces deux nouveaux hydrocarbures, on retrouve de l'hexane :
Le craquage de butane : de la même manière, on obtient :
Sous l'action de la chaleur et de catalyseurs, des chaînes linéaires vont pouvoir être transformées soit en chaînes cyclisées et déshydrogénées, soit en chaînes ramifiées, qui conduisent à des cycles insaturés comportant une ou plusieurs liaisons multiples.
Techniques ne modifiant pas le nombre de carbones :
a)a) Isomérisation et ramifications du squelette carboné :
Dans cette transformation s'effectuant à températures modérées (de l'ordre de à ), on aboutit à une molécule ramifiée à partir d'une molécule linéaire.
Exemple de l'hexane :
b) La déshydrogénation :
On réalise l'élimination d'un atome d'hydrogène porté par chaque atome de carbone engagé dans la réaction.
On notera alors l'apparition d'une double liaison entre deux atomes de carbone liés par une liaison simple.
c) La cyclisation :
Cette réaction se produit dans les mêmes conditions que la précédente. Ici, on transforme un alcane linéaire en cyclane (alcane à chaîne fermée). Cependant cette réaction n'est possible que pour des alcanes possédant au moins 5 atomes de carbone.
Exemple de l'hexane :
d) La cyclisation suivie d'une déshydrogénation :
La cyclisation peut s'effectuer à des températures plus élevées, voisines de . On utilisera un catalyseur, en général du platine () : la réaction sera dans ce cas accompagnée d'une déshydrogénation et conduira à l'apparition d'un cycle benzénique.
Techniques influant sur le nombre de carbone : ces techniques allongent la chaîne carbonée.
a) L'alkylation :
Cette opération consiste à remplacer un atome d'hydrogène d'une chaîne carbonée par un groupe alkyle. Il y a possibilité de la réaliser en combinant un alcane et un alcène.
b) La polymérisation :
Il s'agit de la principale technique, et la plus courante (voir §V).
= Merci à gbm et shadowmiko pour avoir contribué à l'élaboration de cette fiche =