L’extraction liquide-liquide avec un solvant bien choisi, permet d’extraire une espèce chimique d’un liquide. Par leurs propriétés, les savons ont la capacité de solubiliser les taches dans l’eau.
I. Extraction par un solvant
À noter
La phase supérieure est occupée par le liquide de plus faible densité.
Deux liquides sont non miscibles si leur mélange conduit à un mélange hétérogène composé de deux phases, chaque phase étant constituée d’un des liquides.
L’extraction liquide-liquide consiste à prélever une espèce chimique dissoute initialement dans un solvant, à l’aide d’un autre solvant. On utilise pour cela un solvant d’extraction qui doit avoir les propriétés suivantes :
- l’espèce chimique à extraire y est plus soluble que dans le solvant de départ ;
- il est non miscible au solvant de départ.
Pour une extraction liquide-liquide, on utilise une ampoule à décanter.
II. Propriétés lavantes d’un savon
Un savon est un mélange de carboxylate de sodium (ou de potassium) dont la formule s’écrit :
R−CO2Na (ou R−CO2K). On note R une chaîne carbonée non ramifiée qui possède plus de 10 atomes de carbone. Les ions carboxylate RCO−2 possèdent deux parties.
Suivant la nature des salissures, les ions carboxylate interagissent avec celles-ci, soit par leur extrémité lipophile, soit par leur extrémité hydrophile. Il se forme soit une monocouche de savon avec une tache d’origine organique, soit une bicouche avec une tache d’origine minérale.
Méthode
Choisir un solvant d’extraction adapté et schématiser une extraction liquide-liquide
On veut réaliser l’extraction du diiode I2 initialement dissous dans l’eau. On dispose pour cela de 4 solvants dont voici les caractéristiques :
|
Solvant 1 |
Solvant 2 |
Solvant 3 |
Solvant 4 |
|
|
Miscibilité avec l’eau |
non |
oui |
non |
non |
|
Solubilité du diiode dans le solvant (en g.L−1) |
12 |
1,5 |
27 |
0,10 |
|
Densité par rapport à l’eau |
1,8 |
1,1 |
0,8 |
0,9 |
Données :
• la solubilité du diiode dans l’eau est égale à 0,13g.L−1 ;
• la densité de l’eau est égale à 1,0.
a. Quel serait le solvant le plus adapté pour réaliser l’extraction liquide-liquide ?
b. On réalise l’extraction à l’aide d’une ampoule à décanter. Faire le schéma de cette ampoule après l’extraction.
Conseils
a. Rappelez-vous des deux conditions que doivent remplir le solvant d’extraction.
b. Deux solvants non miscibles donnent un mélange hétérogène où la phase supérieure est occupée par le solvant le moins dense.
Solution
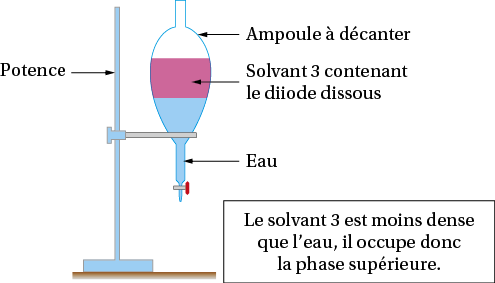
a. Le solvant d’extraction doit être non miscible avec l’eau (solvants 1, 3 et 4), et le diiode à extraire doit y être plus soluble que dans l’eau (solvants 1, 2 et 3). Parmi les solvants 1 et 3 qui conviennent, on choisit celui dont la solubilité du diiode est la plus grande : le solvant 3.
b. On schématise l’ampoule à décanter après l’extraction :
Vérifiez que vous avez bien compris les points clés des autres fiches de la partie "La matière à l'échelle microscopique".