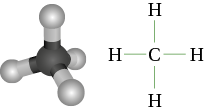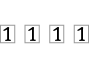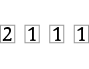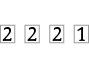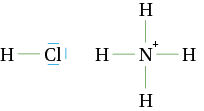Les atomes dans les molécules ou les ions polyatomiques réalisent des liaisons afin d’avoir une structure électronique identique à celle d’un gaz noble. Ces associations d’atomes donnent lieu à différentes géométries.
I. Schéma de Lewis d’un édifice chimique
Un atome partage des électrons de sa couche de valence afin de réaliser des liaisons covalentes avec d’autres atomes et obtenir la structure du gaz noble le plus proche. Pour identifier le nombre de liaisons à réaliser, chaque sous-couche est scindée en cases pouvant contenir deux électrons au maximum.
|
Atome |
Répartition des électrons sur la couche de valence |
Nombre de liaisons à réaliser |
Nombre de doublets non liants |
|
|
carbone C (Z = 6) |
n = 2 |
|
4 |
0 |
|
azote N (Z = 7) |
n = 2 |
|
3 |
1 |
Les doublets non liants sont représentés par des tirets autour des atomes et les doublets liants (deux électrons d’une liaison) par des tirets entre les atomes.
II. Géométrie des molécules ou des ions polyatomiques
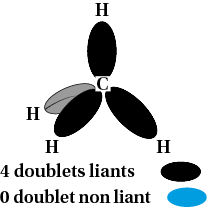
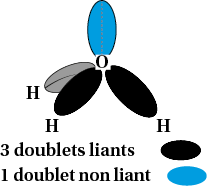
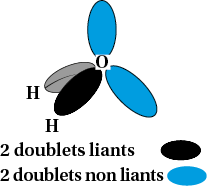
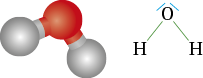
Autour d’un atome, les doublets électroniques liants ou non liants, s’écartent au maximum. Cela donne différentes géométries de molécules ou d’ions.
|
Tétraédrique : atome de carbone dans la molécule de méthane CH4 |
Pyramidale : atome d’azote dans la molécule d’ammoniac NH3 |
Coudée : atome d’oxygène dans la molécule d’eau H2O |
|
|
|
|
|
|
|
|
Méthode
Réaliser un schéma de Lewis, puis identifier une géométrie
Voici les formules brutes de trois entités : A : HCl ; B : NH4+ ; C : H3O+.
N et O ont un électron en moins sur leur couche de valence dans les ions B et C.
Données : Z(H) = 1 ; Z(N) = 7 ; Z(O) = 8 ; Z(Cl) = 17.
a. Déterminer pour chaque atome, le nombre de doublets liants et non liants.
b. Déterminer pour chaque molécule ou ion, le schéma de Lewis.
c. Trouver la géométrie des atomes d’azote N et d’oxygène O dans les ions B et C.
Conseils
a. Scindez les sous-couches en cases, puis commencez le remplissage en mettant un électron dans chaque case. Si la couche de valence est n = 1 alors il y a une seule case. Si n = 2 ou 3, il y a 4 cases.
b. Pour chaque schéma de Lewis, placez les tirets des doublets non liants à côté des symboles des atomes et les doublets liants entre les symboles des atomes liés.
c. Comptez les nombres de doublets liants et non liants de chacun des atomes : c’est ce qui vous donnera leur géométrie dans les ions considérés.
Solution
a.
|
Atome ou ion |
Répartition des électrons sur la couche de valence |
Nombre de liaisons à réaliser |
Nombre de doublets non liants |
|
|
H |
n = 1 |
|
1 |
0 |
|
N (avec un électron en moins) |
n = 2 |
|
4 |
0 |
|
O (avec un électron en moins) |
n = 2 |
|
3 |
1 |
|
Cl |
n = 3 |
|
1 |
3 |
b.
c.
|
Atome d’azote |
4 doublets liants |
0 doublet non liant |
tétraédrique |
|
Atome d’oxygène |
3 doublets liants |
1 doublet non liant |
pyramidale |