Légende de la leçon
Vert : définition
I. Le dosage d'un soluté
Doser un soluté A en solution aqueuse, c’est déterminer sa quantité de matière nA ou sa concentration cA dans la solution.
1) Le dosage par titrage
a) Méthode
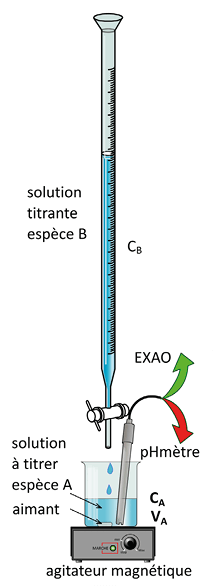
On fait réagir l’espèce à titrer A (par exemple, un acide) avec une espèce titrante B (par exemple, une base) dont la concentration molaire en solution cB est connue.
On verse progressivement la solution titrante. Simultanément, on suit l’évolution d’une propriété de la solution à titrer afin de déterminer l’équivalence.
Définition
À l’équivalence, l’espèce A est totalement transformée par l’espèce B (sans excès de B).
Le titrage pH-métrique
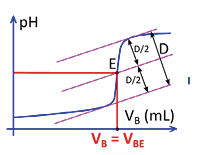
On suit l’évolution du pH de la solution A. On commence par tracer la courbe de cette évolution, mesurée au fur et à mesure que la solution titrante B est ajoutée à la solution à titrer A. On repère l’équivalence E :
- par un saut brusque de pH ;
- par la méthode des tangentes (plus précise) : on trace deux tangentes à la courbe de dosage, l’une avant le saut de pH, l’autre après. On trace une troisième droite équidistante aux tangentes. Celle-ci coupe la courbe au point d’équivalence E.
On relève alors le volume VBE de la solution B versé à l’équivalence.
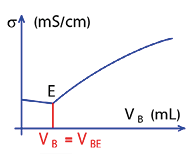
Le titrage conductimétrique
On suit l’évolution de la conductivité σ (capacité à conduire le courant électrique, exprimée en Siemens par mètre) de la solution A. On trace la courbe selon la même méthode. On repère l’équivalence par un changement de pente de la courbe et on relève de la même façon le volume VBE de la solution B versé à l’équivalence E.
b) Détermination de la quantité de matière nA
À l’équivalence, si dans l’équation de réaction de dosage aA + bB → cC + dD, a et b sont égaux, alors on a : nA = nBE, avec nA la quantité de matière de l’espèce A initialement présente (mol) et nBE la quantité de matière de l’espèce B versée à l’équivalence (mol).
On peut calculer cette dernière quantité : nBE = cB × VBE, avec cB la concentration connue de l’espèce B en solution (mol/L) et VBE le volume de solution B à l’équivalence (L).
Donc : nA = cB × VBE.
c) Détermination de la concentration cA de l’espèce A en solution
On sait que nA = cA × VA, avec cA la concentration inconnue de l’espèce A en solution (mol/L) et VA le volume de solution A titrée (L).
D’où : cA × VA = cB × VBE, soit cA = cB × VBEVA.
2) Le dosage par étalonnage
Il consiste à comparer une propriété physique de la solution à doser à la même propriété physique de solutions de concentration connue, dites solutions étalons. Cette méthode de dosage est dite non destructive, car on ne détruit pas l’espèce à doser.
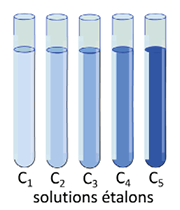
a) Solutions étalons et échelle de teinte
On réalise plusieurs solutions de concentration connue. Si elles sont colorées, l’ensemble constitue une échelle de teinte.
On peut ainsi déterminer la concentration de la solution à doser par comparaison de teinte.
b) Courbe d’étalonnage
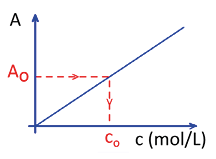
Pour chaque solution-étalon de concentration molaire connue c, on peut mesurer une grandeur physique. On prendra ici l’exemple de l’absorbance A, qui désigne la capacité d’un milieu à absorber la lumière qui le traverse. Elle se mesure avec un spectrophotomètre.
On commence par tracer la courbe de l’absorbance A en fonction de la concentration molaire c à l’aide des mesures effectuées sur les solutions étalons.
Comme l’absorbance est proportionnelle à la concentration molaire (A = k × c), on obtient une droite, passant par l’origine, appelée droite d’étalonnage.
On mesure ensuite l’absorbance A0 pour la solution à doser, puis on détermine la concentration inconnue co par lecture graphique sur la droite d’étalonnage.
3) Le choix entre les deux méthodes
Pour réaliser un dosage par titrage (méthode destructive), il faut trouver une transformation chimique qui permette de faire réagir l’espèce à doser. La réaction doit être totale.
Pour réaliser un dosage par étalonnage (méthode non destructive), il faut que la solution à doser ait une caractéristique physique ou chimique qui soit en relation avec la concentration.
II. L'extraction d'un soluté
1) La solubilité d’une espèce chimique
Le sulfate de cuivre est soluble dans l’eau mais insoluble dans le cyclohexane. La solubilité d’une espèce chimique dépend du solvant.
Dans le cyclohexane, le diiode est soluble, tandis que le sulfate de cuivre est insoluble. La solubilité dans un solvant dépend de l’espèce chimique.
2) L’extraction par solvant
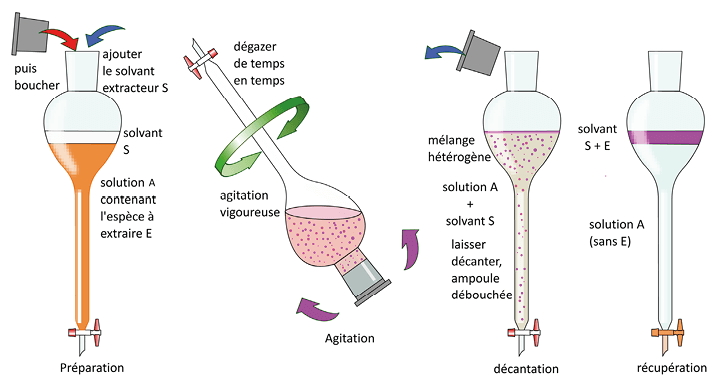
Pour extraire un soluté d’une solution A, il faut choisir un solvant extracteur S tel que :
- l’espèce à extraire E y soit la plus soluble possible ;
- le solvant choisi soit non miscible à la solution A.
Remarque
Si le solvant est moins dense que la solution A, il se place au-dessus, dans le cas contraire, en dessous.
On élimine ensuite la solution A et on récupère la solution S + E. On élimine éventuellement le solvant S par évaporation si on souhaite récupérer E à l’état pur.
Si on a le choix entre plusieurs solvants, on choisit celui qui nuit le moins à l’homme et à son environnement à partir des pictogrammes.