Le tableau périodique
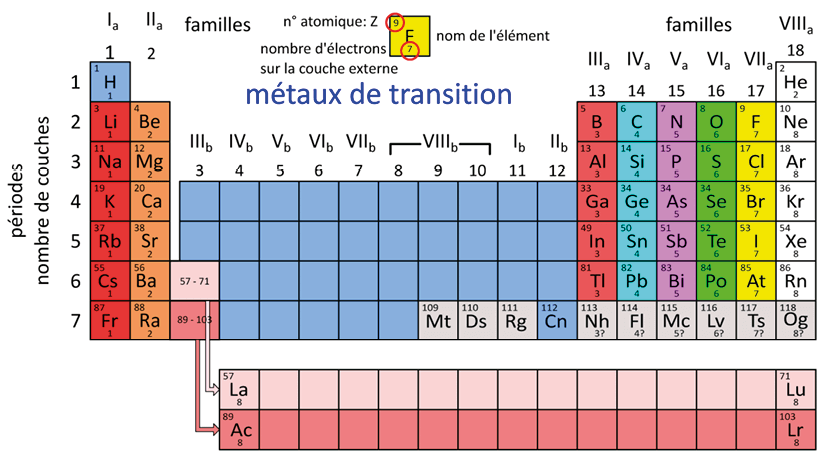
Les éléments sont rangés dans le tableau périodique par ordre de numéro atomique Z (nombre de protons dans le noyau) croissant, en tenant compte de la répartition des électrons par couche.
À savoir
Les propriétés chimiques d’un élément dépendent essentiellement du nombre d’électrons sur la couche externe. Ce nombre est indiqué par la numérotation des colonnes en chiffres romains (Ia → 1 électron, IIa → 2 électrons, etc.), sauf pour l’hélium He, qui est placé dans la colonne VIIIa mais qui n’a que 2 électrons sur sa couche externe.
A) Les familles
Dans le tableau périodique, on peut observer que tous les éléments d’une même colonne ont le même nombre d’électrons sur la dernière couche. Ils auront donc des propriétés chimiques communes et forment pour cette raison une famille.
Il existe 4 familles principales :
colonne 1 (ou Ia) : les alcalins. Ce sont des métaux (sauf l’hydrogène). Ils possèdent un seul électron périphérique. Ils sont très réactifs ;
colonne 2 (ou IIa) : les alcalino-terreux. Ils possèdent deux électrons périphériques ;
colonne 17 (ou VIIa) : les halogènes. Ils possèdent 7 électrons périphériques. Ils sont très réactifs ;
colonne 18 (ou VIIIa) : les gaz inertes (dits aussi gaz rares ou gaz nobles). Leur couche externe est saturée à 2 pour l’hélium (duet) et contient 8 électrons pour les autres (octet). Cette structure leur donne une grande stabilité. Ils sont donc très peu réactifs.
B) Les propriétés communes de certaines familles
a) Les alcalins
Ils ont un aspect brillant à la coupe. Dans les conditions normales de température et de pression, ce sont des solides gris et mous.
Ils réagissent très vivement avec l’eau. La réaction s’accompagne d’un dégagement gazeux (H2) et de formation d’ions HO–. La solution obtenue est très basique.
Ils brûlent dans le dichlore en produisant des fumées blanches (NaCl, KCl).
b) Les halogènes
Les ions halogénures (F–, Cl–, Br–, I–) donnent un précipité en présence de l’ion argent (Ag+).
Les ions halogénures se transforment en dihalogènes sous l’effet des ions permanganate.
Les dihalogènes (F2, Cl2, Br2, I2) sont plus solubles dans le cyclohexane que dans l’eau.
La formation des ions
A) La règle du duet et de l’octet
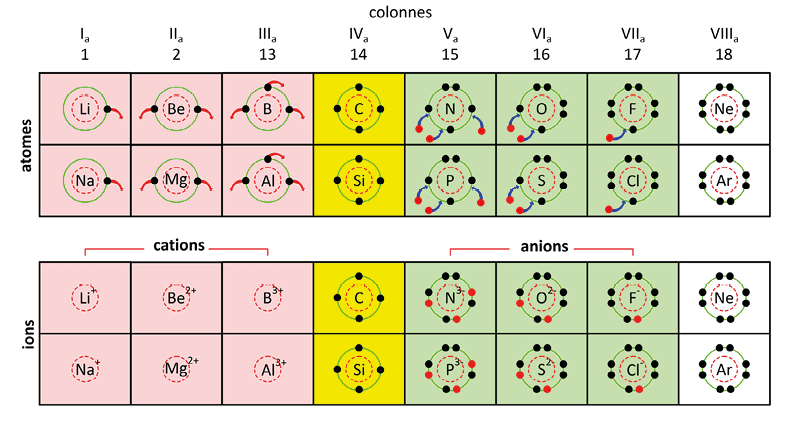
Les atomes se transforment en ions, c’est-à-dire captent ou cèdent un électron, pour gagner en stabilité. En effet, un atome est stable lorsque sa couche électronique externe est saturée à 2 électrons pour la couche K ou contient 8 électrons pour les couches L et M.
C’est le cas des gaz nobles : leur couche électronique externe comporte deux ou huit électrons. Cette stabilité exceptionnelle leur confère une forte inertie chimique (c’est pourquoi ils sont aussi appelés gaz inertes).
Toute transformation chimique d’un atome tend à lui permettre d’acquérir la structure électronique stable en duet ou en octet du gaz noble de numéro atomique (Z) le plus proche, soit :
2 électrons pour l’hélium (duet) ;
8 électrons pour les autres gaz rares.
Remarque
Cette règle ne s’applique qu’aux éléments chimiques des trois premières périodes (lignes) du tableau périodique.
B) Conséquences
Les éléments d’une même colonne forment des ions de même nature (cation ou anion) présentant le même défaut ou excès d’électrons :
les éléments des colonnes Ia, IIa et IIIa perdent un, deux ou trois électrons pour former des cations X+, X2+, X3+ ;
Rappel
Si un atome perd des électrons, il devient un ion positif, appelé cation.
Si un atome gagne des électrons, il devient un ion négatif, appelé anion.
les éléments de la colonne IVa ne forment pas d’ions ;
les éléments des colonnes Va, VIa et VIIa gagnent trois, deux ou un électron(s) pour former des anions X3–, X2–, X– ;
les éléments de la colonne VIIIa (gaz nobles) ne forment pas d’ions.
Les molécules
Une autre façon pour les atomes de gagner en stabilité en suivant la règle du duet et de l’octet est de former des molécules en réalisant des liaisons covalentes (mise en commun d’électrons) avec d’autres atomes.
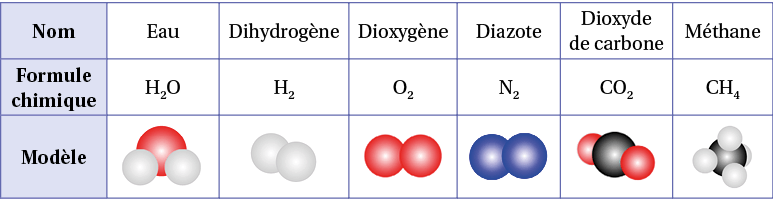
La formule brute d’une molécule donne la nature et le nombre d’atomes qui la composent. Le tableau suivant donne quelques exemples de molécules.