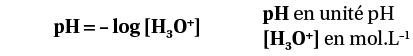Le pH d'une solution aqueuse
A) Définitions
a) Le pH : potentiel hydrogène
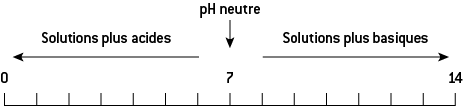
La relation de définition du pH est valable entre 0 et 14, quelles que soient les concentrations des ions.
Une solution acide a un pH compris entre 0 et 7.
Une solution neutre a un pH égal à 7,0.
Une solution basique a un pH compris entre 7 et 14.
Plus le pH est bas (< 7) et plus la solution est acide, inversement, plus le pH est élevé (> 7) et plus la solution est basique.
b) La relation entre pH et concentration en ion H3O+
Les propriétés acides ou basiques d’une solution vont dépendre de la concentration en ion oxonium H3O+, notée [H3O+].
Les chimistes mesurent une grandeur liée à la concentration en ion oxonium notée [H3O+] :
Inversement, la concentration en ions oxonium [H3O+] est liée au pH par : [H3O+] = 10–pH.
Plus une solution contient des ions H3O+, plus son pH est faible.
Exemple
1. Le pH d’une solution est 3,5. La solution est-elle acide ou basique ?
2. Quelle est la concentration en ions oxonium [H3O+] ?
Réponses :
1. Comme le pH est inférieur à 7, la solution est acide.
2. La concentration en ions oxonium se calcule avec [H3O+] = 10–pH, soit :
[H3O+] = 10–3,5 = 3,1 × 10–4 mol.L–1.
B) La mesure du pH
Le pH peut être mesuré avec du papier pH en trempant un agitateur en verre dans la solution à tester et en touchant ensuite le papier pH avec celui-ci. Le papier pH prend ensuite une teinte qui correspond à un certain pH. La méthode est rapide mais peu précise : le pH est déterminé à une unité près.
Une technique plus précise consiste à utiliser un pH-mètre : il faut rincer la sonde de pH avec de l’eau déminéralisée puis l’essuyer avant de la tremper dans la solution. Il faut homogénéiser la solution pour mesurer correctement la valeur du pH. Cette méthode est plus précise : le pH est déterminé à 0,1 près.
Attention
Il faut étalonner le pH-mètre avant de l’utiliser : pour cela, on utilise deux solutions tampon de valeurs connues. On trempe la sonde dans la première solution (pH = 7) et on règle la valeur du pH. On trempe ensuite la sonde dans la seconde solution et on règle la pente du pH-mètre.
Les acides et les bases en solution aqueuse
A) Les acides et les bases selon la théorie de Brönsted
Un acide est une espèce chimique capable de céder un proton H+ en solution aqueuse.
Une base est une espèce chimique capable de capter un proton H+ en solution aqueuse.
Exemple
L’acide éthanoïque CH3COOH est un acide, il peut donc céder un proton H+ selon la demi équation :
CH3COOH = CH3COO– + H+.
B) Les couples acide/base
Un couple acide/base comporte un acide A et une base B. Une demi-équation lie les deux espèces chimiques : A = B + H+
Les espèces A et B sont dites conjuguées et forment le couple A/B. On utilise le signe égal dans les demi-équations. La forme acide est écrite en premier dans un couple acide-base.
Exemple
L’acide méthanoïque a pour formule HCOOH. C’est un acide, il est donc possible d’écrire la demi-équation où il intervient : HCOOH = HCOO– + H+.
Ainsi, l’ion méthanoate HCOO– est la base conjuguée de l’acide méthanoïque.
Les deux espèces forment le couple HCOOH/HCOO–.
La molécule d’eau fait partie de deux couples acide/base : H3O+/H2O et H2O/OH–.Elle peut capter ou céder un proton H+.
C) La réaction acide/base
Une réaction acide/base est une réaction au cours de laquelle il y a un transfert de proton H+. Elle se produit entre l’acide A1Hd’un couple et la base d’un autre couple pour former les deux espèces conjuguées et A2H.
L’équation s’écrit directement : A1H + + A2H car il y a échange d’un seul proton dans chaque couple. On ne sait pas si la réaction est totale ou non.
Ainsi, si on considère la réaction du chlorure d’hydrogène HCl faisant partie du couple HCl/Cl– avec l’eau H2O, il faut prendre H3O+/H2O car HCl doit réagir avec une base. L’équation s’écrit :
Remarque
Il y a une simple flèche car la réaction est totale.
D) Les acides forts
Lors de la réaction avec l’eau, un acide AH va céder un proton à l’eau H2O qui agit comme une base. On obtient alors les deux espèces conjuguées A– et H3O+ selon l’équation :
AH + H2O A– + H3O+
Lorsque l’acide AH est fort, cette réaction avec l’eau est totale et la base conjuguée A– ne réagit pas du tout avec l’eau, elle est très faible. On met une simple flèche dans l’équation :
AH + H2O A– + H3O+
Le pH d’une solution d’acide fort de concentration c peut être calculé selon pH = – log c.
Si pour une solution acide le pH d’une solution est supérieur à – log c, alors il s’agit d’un acide faible.
Remarque
Parmi les acides forts, on trouve le chlorure d’hydrogène HCl, l’acide nitrique HNO3, l’acide sulfurique H2SO4.
E) Les acides faibles
Si l’acide AH est faible, la réaction avec l’eau est partielle : tout l’acide AH ne se transforme pas et la base conjuguée A– est une base faible, elle réagit partiellement avec l’eau. On met un signe = ou une double flèche dans l’équation :
AH + H2O A– + H3O+
Lors de la dilution d’une solution acide, le pH augmente et tend vers 7,0 (la neutralité) si on dilue beaucoup. Dans le cas d’une solution d’acide fort, si la solution est diluée 10 fois, le pH augmente de 1.
Remarque
Parmi les acides faibles, on trouve les acides carboxyliques comme l’acide éthanoïque CH3COOH, l’acide nitreux HNO2, l’acide phosphorique H3PO4, le dioxyde de carbone en solution aqueuse H2O, CO2.
F) Les bases fortes
Lors de la réaction avec l’eau, une base B va capter un proton de l’eau H2O qui agit comme un acide. On obtient alors les deux espèces conjuguées BH+ et HO– selon l’équation :
B + H2O = BH++ HO–
Si la base B est forte, cette réaction avec l’eau est totale et l’acide conjugué BH+ ne réagit pas du tout avec l’eau, il est très faible. On met une simple flèche dans l’équation :
B + H2O BH++ HO–
Le pH d’une solution de base forte de concentration c peut être calculé selon pH = 14 + log c.
Si pour une solution basique le pH d’une solution est inférieur à 14 + log c, alors il s’agit d’une base faible.
G) Les bases faibles
Si la base B est faible, cette réaction avec l’eau est partielle et l’acide conjugué BH+ est un acide faible, il réagit partiellement avec l’eau, il est très faible. On met un signe = ou une double flèche dans l’équation :
B + H2O BH++ H3O+
Lors de la dilution d’une solution basique, le pH diminue et tend vers 7,0 la neutralité si on dilue beaucoup. Dans le cas d’une solution de base forte, si la solution est diluée 10 fois, le pH diminue de 1.
Remarque
Parmi les bases faibles, on trouve l’ammoniac NH3, l’ion carbonate , l’ion phosphate .
Le domaine de prédominance
A) Le produit ionique de l’eau
Comme la molécule d’eau fait partie de deux couples acide/base : H3O+/H2O et H2O/OH–, elle peut réagir sur elle-même selon la réaction : H2O + H2O H3O+ + OH–.
Cette réaction est un équilibre appelé équilibre d’autoprotolyse de l’eau. Un équilibre est une réaction non totale qui semble ne plus avancer. On associe à cet équilibre une constante d’équilibre, appelé produit ionique de l’eau.
À 25 °C, le produit ionique de l’eau est : Ke = [H3O+] × [HO–] = 1,0 × 10–14.
Le produit ionique est une constante. Ainsi, comme le produit entre les concentrations des ions oxonium et hydroxyde doit être constant, lorsqu’une concentration augmente l’autre diminue : plus le pH devient acide, plus la concentration en ions oxonium augmente et plus celle des ions hydroxyde faiblit.
B) La constante d’acidité Ka
On appelle constante d’acidité dans l’eau du couple HA/A–, notée Ka, la grandeur sans dimension associée à l’équation AH + H2O A– + H3O+.
Remarque
Les concentrations sont celles des espèces après réaction. C’est pour cela que l’on place un « f » en indice.
Le pKa d’un couple acide-base est défini par : .
Le pKa d’un couple HA/A– est lié au pH de la solution par la relation : pH = pKa + log .

Les acides forts font partie de couples pour lesquels le pKa est négatif, les bases fortes font partie de couples pour lesquels le pKa est supérieur à 14. Quant aux acides et bases faibles, le pKa du couple associé est compris entre 0 et 14.
C) Le diagramme de prédominance
Le diagramme de prédominance d’un couple acide-base AH/A– est un axe de pH, sur lequel figure le pKa du couple. Il permet de prévoir quelle est l’espèce chimique d’un couple qui prédomine dans une solution dont on connaît le pH.
Ainsi pour le couple CH3COOH/CH3COO–, dont le pKa vaut 4,8, le diagramme de prédominance est :
Dans une solution contenant les espèces CH3COOH et CH3COO–, si le pH = 2,5, l’espèce CH3COOH prédomine ; pour pH = 4,8 = pKa, il y a autant de CH3COOH et de CH3COO– ; si le pH = 6,0, l’espèce CH3COO– prédomine bien que le milieu soit acide.
D) Le cas des acides α-aminés
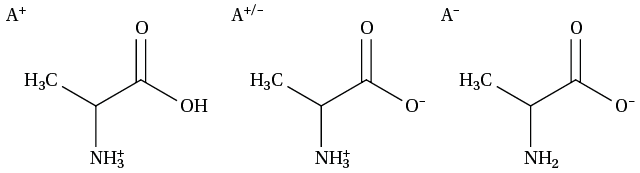
Un acide α-aminé comporte deux fonctions chimiques ayant des propriétés acidobasiques : une fonction amine primaire —NH2 et un groupe acide carboxylique —COOH.
Les fonctions COOH et NH2 peuvent s’ioniser de la façon suivante : —COOH = —COO– + H+ et —NH2 + H+ = —NH3+.
Il y a donc deux constantes d’équilibre Ka et deux pKa.
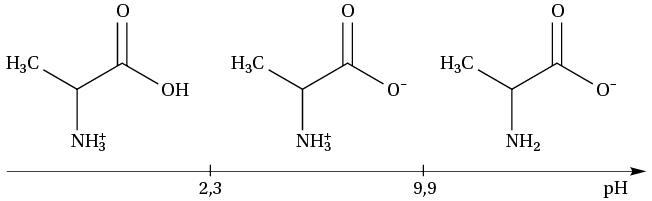
Le pKa1, le plus faible correspond à —COOH/—COO– et le plus fort pKa2 est associé à —NH3+/—NH2
En solution, un acide α-aminé peut exister sous plusieurs ionisations en fonction du pH de la solution.
Un acide α-aminé ne peut exister en solution que sous une de ces trois formes ci-dessus. Aussi, la forme NH2—CRH—COOH avec le radical R est la forme dite solide.
Dans le cas de la glycine, les valeurs des pKA sont pKA1 = 2,3 et pKA2 = 9,9.
E) Les solutions tampon
Une solution tampon est un mélange en même proportion d’un acide et d’une base conjuguée : le pH de la solution est donc égal au pKa du couple.
Une solution tampon a des propriétés importantes : son pH varie peu lors d’un ajour modéré d’un acide ou d’une base ou lors d’une dilution.