La connaissance des configurations électroniques permet de comprendre la construction du tableau périodique des éléments et d’identifier des propriétés communes à certains, regroupés alors par famille chimique.
I Historique
Au XIXe siècle, le chimiste russe Mendeleïev (1834-1907) propose une classification des éléments chimiques par masse atomique croissante et regroupe ceux qui ont des propriétés chimiques communes.
Il est à l’origine de la classification périodique.
II Critère de la classification
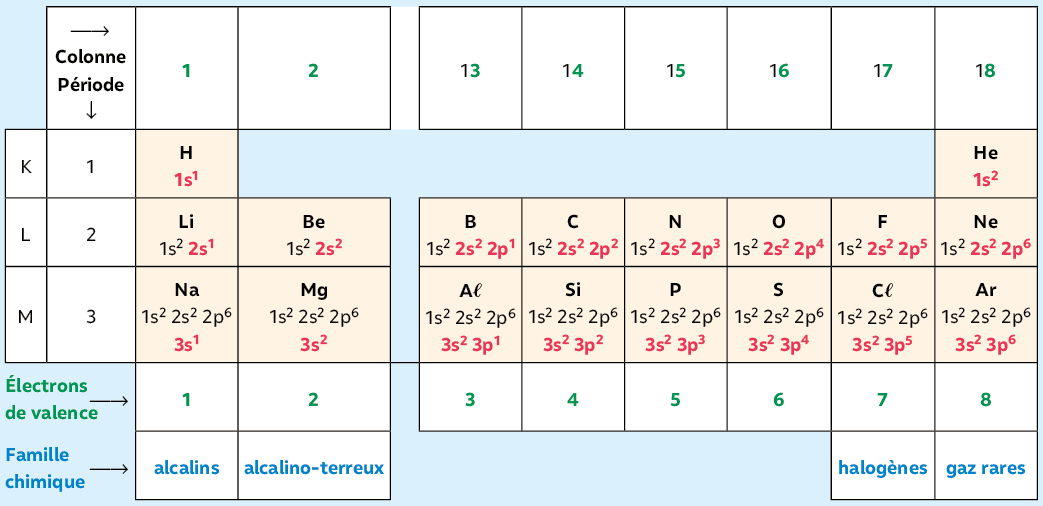
Les éléments chimiques sont classés par numéro atomique Zcroissant.
Le remplissage d’une ligne ou période correspond au remplissage d’une couche électronique (K, L, M…).
Les éléments possédant le même nombre d’électrons de valence sur la couche externe sont placés dans une même colonne.
III Présentation de la classification périodique
Les trois premières périodes sont présentées sur le tableau ci-dessous.
Exemple : du lithium Li au néon Ne, la 2e période est associée au remplissage progressif de la couche électronique L (2s 2p).
Un élément situé dans la ne colonne possède autant d’électrons de valence que l’unité de la colonne.
Exemple : 13e colonne, 3 électrons de valence.
La classification des éléments est qualifiée de périodique car les éléments ayant des propriétés chimiques semblables sont situés dans une même colonne : ils constituent une famille chimique. Cette ressemblance est due à leur configuration électronique externe qui est la même.
Exemples :
• Les gaz rares ou nobles ont une couche externe en duet (2 électrons) pour He sinon en octet (8 électrons). Ils sont très stables (grande inertie chimique).
• Les alcalins (1re colonne) sont des métaux relativement mous qui réagissent vivement avec l’eau.
• Le carbone C et le silicium S ont 4 électrons de valence : 2s2 2p2 pour C et 3s2 3p2 pour Si. Ils sont donc de la même famille (14e colonne).
MéthodePositionner un atome dans la classificationa. Identifier l’atome X de configuration électronique : 1s2 2s2 2p6 3s2 3p3. Quel est son voisin dans la classification périodique ?L’atome d’azote N (Z = 7) fait-il partie de la même famille ?
b. À quelle famille appartiennent les éléments néon (Z = 10) et argon (Z = 18) ? Donner leur configuration électronique.
c. Comment appelle-t-on la famille des éléments dont l’atome possède un seul électron de valence ?
Repère
Conseilsa. La configuration électronique permet de positionner un élément dans la classification périodique (et réciproquement).
Chaque ligne, ou période de la classification, correspond au remplissage d’une couche électronique (1re ligne, couche K ; 2e ligne, couche L…). Le numéro de la couche externe correspond au numéro de la période dans laquelle il se trouve.
b. et c. Recherchez le nombre d’électrons de valence pour trouver la colonne.
Solutiona. La configuration électronique de l’atome X est : 1s2 2s2 2p6 3s2 3p3.
La couche externe de l’atome X est la 3e couche M : 3e ligne ou période.
La couche externe est 3s23p3 elle contient 2 + 3 = 5 électrons de valence. Cet atome se situe donc dans la 15e colonne. Si on regarde à l’intersection de la 15e colonne et 3e ligne, on trouve l’élément phosphore P.
Réciproquement, un élément qui se trouve dans la 15e colonne de la classification possède 5 électrons de valence. S’il se trouve dans la 3e période, alors la dernière couche occupée est la couche M. Les couches K et L sont alors saturées, sa configuration électronique est : 1s2 2s2 2p6 3s2 3p3.
• L’atome qui suit le phosphore dans la classification possède un électron de plus sur sa couche externe, d’où la configuration : 1s2 2s2 2p6 3s2 3p4 ; il s’agit du soufre S (16e colonne, 3e période).
• L’atome d’azote N (Z = 7) possède 7 électrons dans son nuage électronique et a la configuration : 1s2 2s2 2p3. Sa couche externe (L) contient 3 + 2 = 5 électrons de valence comme le phosphore, ils auront alors les mêmes propriétés chimiques. L’azote N fait partie de la même famille que le phosphore. Il se situe juste au-dessus du phosphore dans la même colonne de la classification périodique (15e colonne, 2e période).
b. Ne : 1s2 2s2 2p6 et Ar : 1s2 2s2 2p6 3s2 3p6 possèdent 8 électrons de valence et se situent dans la 18e colonne : ils appartiennent à la famille des gaz rares.
c. Ce sont les éléments de la 1re colonne : famille des alcalins.