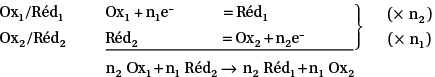Les oxydants et les réducteurs en solution aqueuse
A) Définitions
Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons en solution aqueuse. Quand l’oxydant a capté un ou plusieurs électrons, il est réduit.
Exemple
L’ion Fe2+ est un oxydant, il se transforme en fer métallique en captant 2 électrons : Fe2+ + 2 e– = Fe.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons en solution aqueuse. Quand le réducteur a cédé un ou plusieurs électrons, il est oxydé.
B) Les couples oxydant/réducteur
Un couple oxydant/réducteur comporte un oxydant Ox et un réducteur Réd. Une demi-équation électronique, aussi appelée équation d’oxydo-réduction, lie les deux espèces chimiques :
Oxydant + n e – = Réducteur ou Ox + n e– = Réd
Ox et Réd forment le couple oxydant réducteur Ox/Réd.
On place un signe égal dans les demi-équations électroniques au lieu d’une simple flèche utilisée pour les réactions chimiques.
Attention
La forme oxydante est toujours écrite en premier dans le couple.
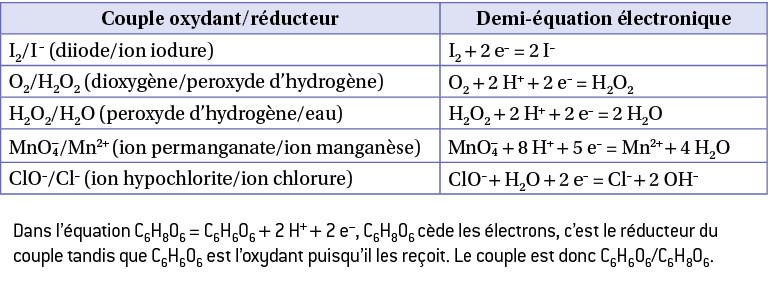
Exemple
Dans l’équation C6H8O6 = C6H6O6 + 2 H+ + 2 e–, C6H8O6 cède les électrons, c’est le réducteur du couple tandis que C6H6O6 est l’oxydant puisqu’il les reçoit. Le couple est donc C6H6O6/C6H8O6.
C) La réaction d’oxydo-réduction
Une réaction d’oxydo-réduction se produit entre l’oxydant Ox1 d’un couple et le réducteur d’un autre couple Réd2. Il y a transfert d’électrons :
le réducteur Réd2 cède des électrons et est oxydé en oxydant Ox2 ;
l’oxydant Ox1 capte les électrons cédés et est réduit en réducteur Réd1.
Le nombre d’électrons cédés par le réducteur 2 est égal au nombre d’électrons captés par l’oxydant 1, car les électrons ne peuvent pas exister à l’état libre en solution aqueuse.
Remarque
En 1re ST2S, vous devez être capable d’écrire l’équation d’oxydo-réduction, les demi-équations électroniques étant données.
Exemple
En utilisant le tableau précédent, écrire l’équation d’oxydation des ions iodure I – par les ions permanganate MnO4–.
Les couples et les demi-équations qui interviennent sont :
/Mn2+ : + 8 H+ + 5 e– = Mn2++ 4 H2O
et I2/I – : I2 + 2 e– = 2 I –
Il faut multiplier la première par 2 et la seconde par 5 pour avoir le même nombre d’électrons dans chacune, soit :
/Mn2+ : + 16 H+ + 10 e– = 2 Mn2++ 8 H2O et I2/I –. : 5 I2 + 10 e– = 10 I –.
L’équation finale est alors : + 16 H+ + 10 I – → 2 Mn2++ 8 H2O + 5 I2
Les propriétés oxydantes des produits ménagers et pharmaceutiques
A) Définitions
Un antiseptique est un produit ou un procédé employé pour assurer l’antisepsie dans les conditions précises. Les antiseptiques ont souvent un caractère oxydant.
L’antisepsie est une opération permettant d’éliminer les micro-organismes et les virus au niveau des tissus vivants. Le résultat de cette opération est momentané.
La désinfection permet d’éliminer les micro-organismes et les virus indésirables portés par des milieux inertes contaminés. Le résultat de cette opération est momentané. Un désinfectant est un produit utilisé pour la désinfection.
Certains produits ont un spectre large : ils agissent sur un grand nombre de micro-organismes, d’autres ont un spectre étroit, leur action est nettement plus limitée.
B) Exemples de désinfectants et d’antiseptiques
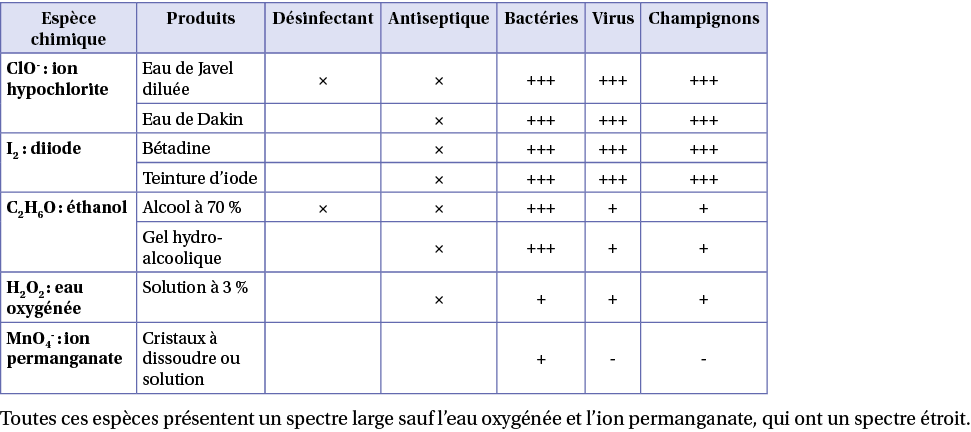
Toutes ces espèces présentent un spectre large sauf l’eau oxygénée et l’ion permanganate, qui ont un spectre étroit.
C) Les précautions d’emploi des antiseptiques et désinfectants
Les espèces chimiques actives contenues dans les antiseptiques et les désinfectants subissent des altérations avec le temps, la température ou la lumière. Il convient donc de les stocker séparément à l’abri de la lumière et de la température dans un endroit adapté.
Ainsi, l’eau oxygénée se décompose d’autant plus vite au cours du temps avec la présence de lumière et une température élevée selon : 2 H2O2 + 2 H+ = 2 H2O + O2.
Par ailleurs, leur usage nécessite de lire convenablement la notice, de les manipuler après s’être lavé les mains et d’éviter tout contact avec l’ouverture du flacon.
Il faut absolument proscrire tout mélange entre ces produits ou avec d’autres produits ménagers comme on peut le voir dans le cas de l’eau de Javel, qui peut former un gaz extrêmement toxique le dichlore Cl2, en milieu acide.
Exemple
Il faut considérer les couples HClO/Cl2 et Cl2/Cl. Les réactifs sont alors HClO– et Cl–.
Les demi-équations électroniques de ces couples sont écrites dans le sens de la réaction :
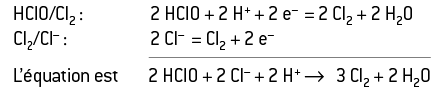
On ajoute ces deux équations car le même nombre d’électrons intervient.
Il ne faut donc jamais verser une espèce acide (acide chlorhydrique, détartrant, vinaigre...) dans de l’eau de Javel. Le dichlore produit est très dangereux.