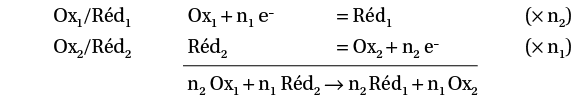Les réactions d'oxydo-réduction et les transferts d'électrons
A) Les oxydants et les réducteurs
Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons en solution aqueuse. Quand l’oxydant a capté un ou plusieurs électrons, il est réduit.
Remarque
Les antiseptiques ont souvent un caractère oxydant.
Exemple
L’ion Fe2+ est un oxydant, il se transforme en fer métallique Fe en captant 2 électrons :
Fe2+(aq) + 2 e– = Fe(s)
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons en solution aqueuse. Quand le réducteur a cédé un ou plusieurs électrons, il est oxydé.
Exemple
Le lithium métallique Li est réducteur, il se transforme en ion lithium Li+ en cédant un électron :
Li(s) = Li+(aq) + e–
B) Les couples oxydant/réducteur
Un couple oxydant/réducteur comporte un oxydant Ox et un réducteur Réd. Une demi-équation électronique ou d’oxydo-réduction lie les 2 espèces chimiques :
Oxydant + n e– = Réducteur
Ox + n e– = Réd
Ox et Réd forment le couple oxydant/réducteur Ox/Réd. Ce sont des espèces conjuguées.
Attention
La forme oxydante est toujours écrite en premier dans un couple oxydant/réducteur.
On place un signal égal dans les demi-équations électroniques au lieu d’une simple flèche utilisée pour les réactions chimiques.
Exemples
Exemple 1
Indépendant du milieu : couple I2(aq)/I–(aq)
La demi-équation électronique est : I2(aq) + n e– = I–(aq).
Il faut assurer la conservation de l’élément iode dans cette demi-équation. Or à gauche, le diiode contient 2 éléments iode. Il en faut donc aussi 2 à droite, ce qui est obtenu en plaçant un coefficient 2 devant l’ion iodure I– : I2(aq) + n e– = 2 I–(aq).
Il faut ensuite équilibrer l’équation au niveau des charges électriques : à droite, la charge globale est –2. Il faut donc ajouter 2 électrons à gauche pour obtenir la même charge –2 à gauche :
I2(aq) + 2 e– = 2 I–(aq)
La demi-équation est alors équilibrée.
Exemple 2
En milieu acide : couple Cr2O72–(aq)/Cr3+(aq)
La demi-équation électronique est : Cr2O72–(aq) + n e– = Cr3+(aq).
Il faut assurer la conservation de l’élément chrome. Or à gauche, l’ion dichromate Cr2O72– contient 2 éléments chrome. Il en faut aussi 2 à droite, ce qui est obtenu en plaçant un coefficient 2 devant Cr3+ : Cr2O72–(aq) + n e– = 2 Cr3+(aq).
Il faut assurer la conservation de l’élément oxygène. Or à gauche, l’ion dichromate contient 7 éléments oxygène. Il en faut aussi 7 à droite.
Pour ajouter un élément oxygène d’un côté en milieu acide, on place une molécule d’eau de ce côté et 2 ions hydrogène (souvent appelés « protons ») de l’autre côté.
On place alors 7 molécules d’eau à droite pour ajouter les 7 éléments oxygène et 14 ions hydrogène H+ à gauche pour assurer la conservation en élément hydrogène :
Cr2O72–(aq) + 14 H+(aq) + n e– = 2 Cr3+(aq) + 7 H2O(liq)
Il faut ensuite équilibrer l’équation en charges électriques : à droite, la charge globale est + 6, il faut donc ajouter 6 électrons à gauche pour obtenir la même charge + 6 à gauche :
Cr2O72–(aq) + 6 e– + 14 H+(aq) = 2 Cr3+(aq) + 7 H2O(liq)
La demi-équation est alors équilibrée.
C) La réaction d’oxydo-réduction
Une réaction d’oxydo-réduction se produit entre l’oxydant Ox1 d’un couple et le réducteur d’un autre couple Réd2. Il y a transfert d’électrons :
le réducteur 2 cède des électrons et est oxydé en oxydant 2 ;
l’oxydant 1 capte les électrons cédés et est réduit en réducteur 1.
Le nombre d’électrons cédés par le réducteur 2 est égal au nombre d’électrons captés par l’oxydant 1, car les électrons ne peuvent pas exister à l’état libre en solution aqueuse.
La corrosion des matériaux
A) Définition
La corrosion est l’altération d’un matériau au cours d’une réaction chimique avec un oxydant : en général le dioxygène de l’air. Elle peut être associée à des effets mécaniques ou des usures de surfaces. Le coût de la corrosion, correspondant aux moyens de lutte contre la corrosion, le remplacement des pièces et l’implication des accidents dus à la corrosion, est estimé à 2 % du produit national brut mondial.
La rouille du fer et de l’acier, la formation de vert-de-gris sur le cuivre et ses alliages (bronze, laiton) et le ternissement de l’aluminium en alumine correspondent à l’oxydation des métaux à l’air ou dans l’eau. L’étude fondamentale de la corrosion des métaux est liée à l’éléctrochimie.
La corrosion affecte aussi d’autres matériaux, comme les céramiques et les polymères dans des conditions variables (hautes températures, milieu aqueux, atmosphère de la Terre oxydante).
Exemples
L’aluminium Al s’oxyde en présence d’air pour former l’alumine, qui forme une couche d’oxyde en surface imperméable à l’air ce qui protège le métal de la corrosion : 2 Al + 3 O2 → Al2O3.
Dans le cas du fer Fe, la réaction en présence d’eau forme différents composés. Une des réactions chimiques est 4 Fe + 3 O2 + 2 H2O → 4 FeOOH et ensuite 2 FeOOH → H2O + Fe2O3. La couche d’oxyde étant poreuse, elle ne protège pas le fer de l’oxydation en profondeur, la pièce en fer ou en acier est corrodée.
B) Les métaux et alliages résistants à la corrosion
Sont résistants à la corrosion :
les métaux nobles : l’or, le platine, argent, rhodium, palladium…) ;
d’autres métaux tels le titane et le tantale ;
des alliages comme les aciers inoxydables riches en chrome et pauvres en carbone.
C) La protection contre la corrosion
Pour protéger des pièces de ce phénomène, il existe plusieurs techniques :
l’ajout au métal en fusion d’un élément pouvant s’oxyder rapidement et former une couche d’oxydes imperméable (les atomes de chrome dans l’acier réagissent avec le dioxygène de l’air et forment une couche protectrice d’oxyde de chrome) ;
la protection cathodique : le métal à protéger devient la cathode de la pile formée avec un autre métal plus réducteur. Par exemple, la galvanisation est une protection cathodique dans laquelle le recouvrement par du zinc plus réducteur que l’acier, permet de le protéger : on a alors une double protection, par passivation et protection cathodique ;
la protection cathodique par anode sacrificielle : le métal à protéger est connecté électriquement à une pièce d’un métal plus oxydable, placée elle aussi dans le milieu corrosif (du zinc est utilisé pour protéger les coques de bateaux et les conduites souterraines en fer) ;
la protection cathodique par courant imposé : le pôle négatif d’un générateur de courant continu est connecté à la pièce à protéger et le pôle positif est relié à une anode sacrificielle en graphite par exemple).
Les piles
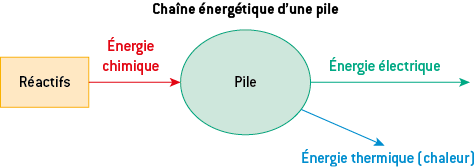
Le nom de pile a été donné initialement à un empilement de rondelles de 2 métaux différents en contact grâce à une solution ionique conduisant le courant (électrolyte). Une pile est désormais un générateur électrochimique monobloc constitué d’un seul élément, non rechargeable.
Une pile est un convertisseur d’énergie dont la chaîne énergétique est :
A) Le transfert direct d’électrons
Si on plonge une lame métallique de zinc dans un bécher contenant une solution d’ions cuivre Cu2+(aq), la lame se couvre progressivement de cuivre métallique et la solution se décolore. 2 couples oxydant/réducteur interviennent :
Cu2+(aq)/Cu(s) et Zn2+(aq)/Zn(s)
Une réaction d’oxydo-réduction se produit entre le zinc et les ions cuivre selon :
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s).
Un transfert d’électrons se produit directement entre le zinc et les ions cuivre.
B) La constitution d’une pile de laboratoire
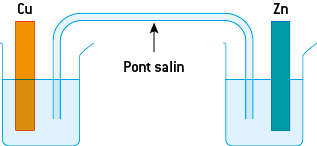
Il est possible de réaliser un transfert d’électrons, de manière indirecte, en réalisant une pile. La pile permettant de reproduire la réaction précédente est composée de :
2 compartiments, appelés demi-piles contenant une solution ionique d’un ion métallique dans laquelle trempe une électrode métallique du même métal ;
un pont salin permettant la circulation des ions entre les 2 demi-piles. Ce pont salin est constitué d’une solution ionique gélifiée placée dans un tube en U ou d’un simple papier imbibé d’une solution ionique. Les ions présents dans le pont salin assurent la continuité électrique entre les 2 solutions : des électrons ne pourraient pas passer directement.
Cette pile met en jeu les 2 couples Cu2+(aq)/Cu(s) et Zn2+(aq)/Zn(s).
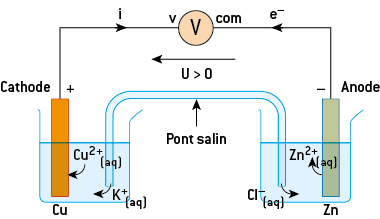
C) La polarité d’une pile : mise en évidence des réactifs
Si l’on connecte l’électrode de cuivre à la borne volt du voltmètre et l’électrode de zinc à la borne « com » du voltmètre, on mesure une tension positive.
L’oxydation se fait sur l’électrode d’où sont issus les électrons, donc la borne négative. La réduction se produit sur l’autre électrode, qui reçoit les électrons, donc la borne positive.
Cette pile comporte 2 demi-piles contenant les couples Cu2+(aq)/Cu(s) et Zn2+(aq)/Zn(s).
L’oxydation a lieu sur l’électrode négative, il y a oxydation du réducteur du couple, donc oxydation du zinc selon l’équation :
Zn = Zn2+ + 2 e–
La réduction a lieu sur l’électrode positive de cuivre, il y a donc réduction des ions Cu2+, ce qui conduit à un dépôt de cuivre métallique sur cette électrode selon l’équation :
Cu2+(aq) + 2 e− = Cu(s)
La réaction globale se produisant dans la pile est donc :
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
C’est la même réaction que celle qui s’effectue spontanément entre une lame métallique de zinc et des ions cuivre en solution. La pile permet d’utiliser une partie de l’énergie chimique transformée en énergie électrique.
La transformation chimique correspond à la réaction entre l’oxydant d’un couple et le réducteur d’un autre couple. La réaction ne se fait pas directement entre les 2 espèces (c’est pour cela que le transfert est indirect) sinon on ne pourrait pas extraire d’énergie électrique de cette réaction.