On supposera tout au long de cette fiche que le système étudié est fermé, de volume constant et de composition uniforme.
I. Transformations (ou réactions) rapides ou lentes
1. Transformations rapides
Définition :
Une transformation (ou réaction) rapide se fait quasi instantanément, dès que les réactifs sont en contact.
Exemples :
Réaction entre et ;
Réaction entre et en milieu acide.
2. Transformations lentes
Définition :
Une transformation (ou réaction) lente peut durer quelques minutes à plusieurs jours. Les produits ne se forment que progressivement.
Exemple : réaction entre et . Il se forme qui colore le mélange réactionnel en jaune puis brun de plus en plus foncé, au fur et à mesure que le temps passe.
3. Transformations infiniment lentes ou bloquées
Définition :
Le système chimique ne semble pas évoluer au cours du temps. La réaction peut durer plusieurs mois ou plusieurs années.
Exemple : formation de la rouille.
4. Les facteurs cinétiques d'une transformation chimique
Pour plus de détails, lire la fiche suivante :
Les facteurs cinétiques d'une transformation chimique
5. Les catalyseurs d'une transformation chimique
Pour plus de détails, lire la fiche suivante :
Les catalyseurs d'une transformation chimique
II. Suivi de l'évolution temporelle d'une transformation chimique
1. Vitesse volumique d'une transformation
Définition :
À la date , la vitesse volumique d'une transformation se déroulant dans un volume constant est la valeur de la dérivée par rapport au temps de l'avancement de la réaction, divisée par le volume :
2. Détermination de la vitesse volumique d'une transformation
Pratiquement, on ne dispose pas de la fonction . On a une série de points expérimentaux qui permettent de tracer la courbe .
Propriété :
La valeur de la dérivée par rapport au temps de l'avancement , pour , est donnée par le coefficient directeur de la tangente à la courbe au point d'abscisse .
Rappel de mathématiques :
Ainsi on retiendra la formule suivante :
3. Évolution de la vitesse volumique d'une transformation
Soit et
On constate dès lors que : coefficient directeur de () coefficient directeur de ()
Or, la vitesse volumique de la transformation peut s'écrire :
;
.
Finalement, .
Propriété :
Au fur et à mesure que le temps passe, la tangente à la courbe se couche de plus en plus sur l'horizontale. Ainsi son coefficient directeur diminue et donc la vitesse volumique de la transformation diminue.
4. Évolution des concentrations des réactifs et des produits
Considérons la transformation suivante : .
On établit le tableau d'avancement de cette transformation :
A un instant , les quantités de matière des réactifs disparaissant et des produits apparaissant s'expriment en fonction de l'avancement de cette réaction :
;
;
;
.
Or, par définition de la vitesse volumique de la transformation :
Pour le :
si est la concentration en quantité de matière de à l'instant ;
Pour le , on peut également démontrer que :
si est la concentration en quantité de matière de à l'instant ;
Pour le , on peut aussi démontrer que :
si est la concentration en quantité de matière de à l'instant ;
Pour le , on peut enfin démontrer que :
si est la concentration en quantité de matière de à l'instant .
Vitesses d'apparition et de disparition :
Les vitesses de disparition des réactifs s'écrivent :
pour le réactif ;
pour le réactif .
Les vitesses d'apparition des produits s'écrivent :
pour le produit ;
pour le produit .
Exemple : réaction entre et
On mélange une solution de concentration et de volume avec une solution de concentration et de volume .
L'équation de la réaction lente étudiée est .
On peut éventuellement tracer un tableau d'avancement de cette réaction lente.
Ici, l'avancement de la réaction est et = concentration molaire du diiode dans le mélange réactionnel si = volume du mélange réactionnel = constante.
Finalement,
Or , d'où
Conclusion : la vitesse volumique de cette transformation à la date est la valeur de la dérivée de la concentration molaire du diiode par rapport au temps .
III. Temps de demi-réaction et loi de vitesse d'ordre 1
1. Notion de temps de demi-réaction
Définition :
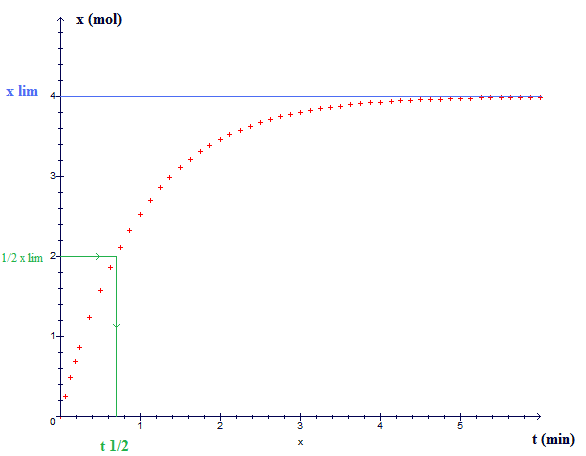
Le temps de demi-réaction, noté , est la durée nécessaire pour que l'avancement de la réaction soit égal à la moitié de sa valeur limite.
2. Détermination pratique du temps de demi-réaction
On lit la courbe si la réaction est totale .
3. Loi de vitesse d'ordre 1
Énoncé de la loi :
Pour des transformations dites d'ordre par rapport à un réactif , la vitesse volumique de disparition de cette espèce est proportionnelle à sa concentration en quantité de matière :
est la vitesse de disparition du réactif () ;
constante de vitesse () ;
concentration en quantité de matière du réactif ().
Remarques :
La courbe représentant la vitesse de disparition de en fonction de sa concentration en quantité de matière est alors une droite passant par l'origine ;
Le temps de demi-réaction d'une transformation d'ordre ne dépend que de la constante de vitesse : elle ne dépend donc pas de la concentration en quantité de matière initiale du réactif .
= Merci à gbm pour avoir contribué à l'élaboration de cette fiche =